
��10�֣�
I.(4��)ij�¶��µ���Һ�У�c(H��)=10x mol/L,c(OH��)=10y mol/L��x��y�Ĺ�ϵ��ͼ��ʾ��
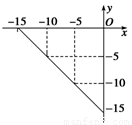
��1�����¶���,������Һ��pH= ��
��2�����¶���0.01 mol/L NaOH��Һ��pH= ��
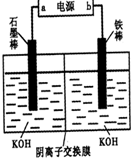
II. (6��)ij�о�С����ʵ����̽����������泥�NH2COONH4���ֽⷴӦƽ�ⳣ����ˮ�ⷴӦ���ʵIJⶨ��
��1����һ���������İ���������������Ƶ��ܱ����������(��������������䣬��������������Բ���)���ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺NH2COONH4(s) 2NH3(g)��CO2(g)��ʵ���ò�ͬ�¶��µ�ƽ�����������±���
2NH3(g)��CO2(g)��ʵ���ò�ͬ�¶��µ�ƽ�����������±���
|
�¶�(��) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
|
ƽ����ѹǿ(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
|
ƽ��������Ũ�� (��10��3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
�ٿ����жϸ÷ֽⷴӦ�Ѿ��ﵽ��ѧƽ����� ������ĸ����
A��2v(NH3)=v(CO2) B���ܱ���������ѹǿ����
C���ܱ������л��������ܶȲ��� D���ܱ������а����������������
�ڸ��ݱ������ݣ�����25.0��ʱ�ķֽ�ƽ�ⳣ��Ϊ ��
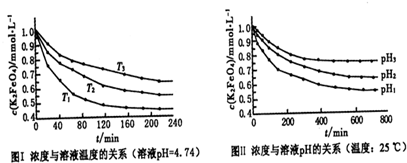
��2����֪��NH2COONH4��2H2O NH4HCO3��NH3��H2O�����о�С��ֱ������ݲ�ͬ��ʼŨ�ȵİ����������Һ�ⶨˮ�ⷴӦ���ʣ��õ�c(NH2COO��)��ʱ��仯������ͼ��ʾ��
NH4HCO3��NH3��H2O�����о�С��ֱ������ݲ�ͬ��ʼŨ�ȵİ����������Һ�ⶨˮ�ⷴӦ���ʣ��õ�c(NH2COO��)��ʱ��仯������ͼ��ʾ��
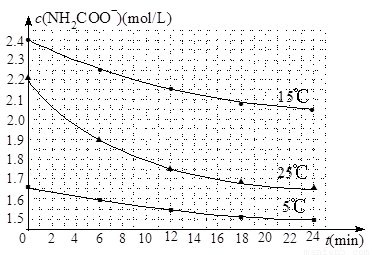
�ۼ���25��ʱ��0��6min���������ˮ�ⷴӦ��ƽ������Ϊ ��
�ܸ���ͼ����Ϣ�����˵��ˮ�ⷴӦ��ƽ���������¶����߶�����
��
I.(4��)��1��7.5 ��2�֣� ��2��13��2�֣�
II. (6��)��1����BC��2�֣��� ��1.6��10��8��mol��L��1)3��2�֣�
��2����0.05mol��L��1��min��1��(1��) ��25�淴Ӧ�����ʼŨ�Ƚ�С����0��6min��ƽ����Ӧ���ʣ����ߵ�б�ʣ��Ա�15���(1��)
��������I.��1������ͼ���֪���¶���ˮ�����ӻ�������1��10��15�����¶���,������Һ��pH=7.5��
��2��0.01 mol/L NaOH��ҺOH����Ũ����0.01mol/L��������������1��10��13mol/L�����pH��13��
II.��1������һ�������£������淴Ӧ������Ӧ���ʺ��淴Ӧ�������ʱ������Ϊ0������Ӧ��ϵ�и������ʵ�Ũ�Ȼ������ٷ����仯��״̬����Ϊ��ѧƽ��״̬������ȷ������������֮������Ӧ�Ļ�ѧ������֮�ȡ���Ӧǰ������DZ仯�ģ�����ѹǿҲ�DZ仯�ģ����B����˵�����ܶ��ǻ�����������������ݻ��ı�ֵ���ڷ�Ӧ�������ݻ�ʼ���Dz���ģ��������DZ仯�ģ�����C��ȷ������ֻ�������������壬�������ķ���ʼ���Dz���ģ�D����ȷ����ѡBC��
�ڸ������ݿ�֪��ƽ��ʱ������0.0048mol/L��3��2��0.0032mol/L������CO2��0.0016mol/L�����ƽ�ⳣ����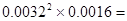 1.6��10��8��mol��L��1)3��
1.6��10��8��mol��L��1)3��
��2����25��ʱ��0��6min��������淋�Ũ�ȼ�С��2.2mol/L��1.9mol/L��0.3mol/L�����Է�Ӧ������0.3mol/L��6min��0.05mol��L��1��min��1��
�ܸ���ͼ���֪��25�淴Ӧ�����ʼŨ�Ƚ�С����0��6min��ƽ����Ӧ���ʣ����ߵ�б�ʣ��Ա�15�����˵��ˮ�ⷴӦ��ƽ���������¶����߶�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�꼪��ʡ������ʮһ���и�һ��ѧ����ĩ���Ի�ѧ�Ծ����������� ���ͣ�ʵ����
��10�֣�
I.(4��)ij�¶��µ���Һ�У�c(H��)=10x mol/L,c(OH��)=10y mol/L��x��y�Ĺ�ϵ��ͼ��ʾ��
��1�����¶���,������Һ��pH= ��
��2�����¶���0.01 mol/L NaOH��Һ��pH= ��
II. (6��)ij�о�С����ʵ����̽����������泥�NH2COONH4���ֽⷴӦƽ�ⳣ����ˮ�ⷴӦ���ʵIJⶨ��
��1����һ���������İ���������������Ƶ��ܱ����������(��������������䣬��������������Բ���)���ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺NH2COONH4(s) 2NH3(g)��CO2(g)��ʵ���ò�ͬ�¶��µ�ƽ�����������±���
2NH3(g)��CO2(g)��ʵ���ò�ͬ�¶��µ�ƽ�����������±���
| �¶�(��) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| ƽ����ѹǿ(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| ƽ��������Ũ�� (��10��3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
 NH4HCO3��NH3��H2O�����о�С��ֱ������ݲ�ͬ��ʼŨ�ȵİ����������Һ�ⶨˮ�ⷴӦ���ʣ��õ�c(NH2COO��)��ʱ��仯������ͼ��ʾ��
NH4HCO3��NH3��H2O�����о�С��ֱ������ݲ�ͬ��ʼŨ�ȵİ����������Һ�ⶨˮ�ⷴӦ���ʣ��õ�c(NH2COO��)��ʱ��仯������ͼ��ʾ��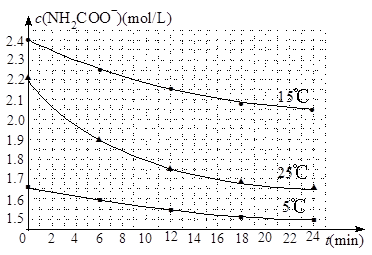
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012���㽭������ѧ�߶���ѧ�ڵڶ����¿���ѧ�Ծ���ƽ�аࣩ�������棩 ���ͣ������
(12��)������ʵĵ���ƽ�⡢�����ˮ��ƽ������������Һƽ������ڻ�ѧƽ�⡣
I����֪H2A��ˮ�д�������ƽ�⣺H2A H��+HA����HA��
H��+HA����HA�� H��+A2����
H��+A2����
��NaHA��Һ��pH (����ڡ�С�ڻ����) Na2A��Һ��pH��
��ij�¶��£�����0.1 mol/L��NaHA��Һ����εμ�0.1 mol/L KOH��Һ����Һ�����ԡ���ʱ�û����Һ�����й�ϵ�У�һ����ȷ���� ��
a��c(H��)��c(OH��)��1��10�D14 b��c(Na��)+c(K��)��c(HA��)+2c(A2��)
c��c(Na��)��c(K��) d��c(Na��)+c(K��)��0.05 mol/L
����֪������H2A�ĸ���(CaA)������Һ�д�������ƽ�⣺
CaA(s) Ca2��(aq)+A2��(aq)
��H��0��
Ca2��(aq)+A2��(aq)
��H��0��
�ٽ����¶�ʱ��Ksp (���������С�����䡱)��
�ڵμ�����Ũ���ᣬc(Ca2��) (���������С�����䡱)��
II������Cr2O72���ķ�ˮ���Խϴ�ij������ˮ�к�5.00��10��3 mol��L��1��Cr2O72����Ϊʹ��ˮ�ܴ���ŷţ������´�����

��1���÷�ˮ�м����̷�(FeSO4��7H2O)��H+��������Ӧ�����ӷ���ʽΪ�� ��
��2����ʹ10L�÷�ˮ�е�Cr2O72����ȫת��ΪCr3+����������Ҫ���� g FeSO4��7H2O��
��3����������ķ�ˮ�в�����c(Fe3+)��2��10��13mol��L��1���������Cr3+��Ũ��Ϊ ��(��֪��Ksp[Fe(OH)3]��4.0��10��38 Ksp[Cr(OH)3]��6.0��10��31)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 I.(4��)ij�¶��µ���Һ�У�c(H��)=10x mol/L,c(OH��)=10y mol/L��x��y�Ĺ�ϵ��ͼ��ʾ��
I.(4��)ij�¶��µ���Һ�У�c(H��)=10x mol/L,c(OH��)=10y mol/L��x��y�Ĺ�ϵ��ͼ��ʾ��
��1�����¶���,������Һ��pH= ��
��2�����¶���0.01 mol/L NaOH��Һ��pH= ��
II. (6��)ij�о�С����ʵ����̽����������泥�NH2COONH4���ֽⷴӦƽ�ⳣ����ˮ�ⷴӦ���ʵIJⶨ��
��1����һ���������İ���������������Ƶ��ܱ����������(��������������䣬��������������Բ���)���ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺NH2COONH4(s)![]() 2NH3(g)��CO2(g)��ʵ���ò�ͬ�¶��µ�ƽ�����������±���
2NH3(g)��CO2(g)��ʵ���ò�ͬ�¶��µ�ƽ�����������±���
| �¶�(��) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| ƽ����ѹǿ(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| ƽ��������Ũ�� (��10��3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
�ٿ����жϸ÷ֽⷴӦ�Ѿ��ﵽ��ѧƽ����� ������ĸ����
A��2v(NH3)=v(CO2) B���ܱ���������ѹǿ����
C���ܱ������л��������ܶȲ��� D���ܱ������а����������������
�ڸ��ݱ������ݣ�����25.0��ʱ�ķֽ�ƽ�ⳣ��Ϊ ��
��2����֪��NH2COONH4��2H2O![]() NH4HCO3��NH3��H2O�����о�С��ֱ������ݲ�ͬ��ʼŨ�ȵİ����������Һ�ⶨˮ�ⷴӦ���ʣ��õ�c(NH2COO��)��ʱ��仯������ͼ��ʾ��
NH4HCO3��NH3��H2O�����о�С��ֱ������ݲ�ͬ��ʼŨ�ȵİ����������Һ�ⶨˮ�ⷴӦ���ʣ��õ�c(NH2COO��)��ʱ��仯������ͼ��ʾ��
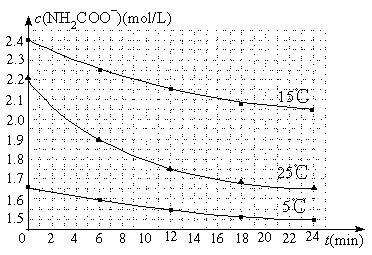
�ۼ���25��ʱ��0��6min���������ˮ�ⷴӦ��ƽ������Ϊ ��
�ܸ���ͼ����Ϣ�����˵��ˮ�ⷴӦ��ƽ���������¶����߶�����
��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com