
【题目】(1)有下列物质:a.碳棒;b.盐酸;c.H2SO4; d.氨水;e.熔融KOH;f.NH3;g.CCl4;h.CO2;i.冰醋酸;j.NaHSO4固体
①上述物质中,可导电的是:___;
②上述物质中,属于非电解质的是:____;
③上述物质中,属于电解质但不导电的是:_____;
④上述物质中,属于弱电解质的是:____.
⑤写出 i、j两种物质在水溶液中的电离方程式:i:____;j:____。
(2)25℃时,pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为____(体积变化忽略不计).
(3)有三瓶pH均为2的盐酸、硫酸溶液、醋酸溶液,设三种溶液的物质的量浓度依次为c1、c2、c3,则它们之间由小到大的顺序为_____(用c1、c2、c3排序).
【答案】abde fgh cij i CH3COOHCH3COO-+H+ NaHSO4=Na++H++![]() 10:1 c2<c1<c3
10:1 c2<c1<c3
【解析】
a.碳棒是单质,可导电;b.盐酸是混合溶液,能导电;c.H2SO4是化合物,是强电解质; d.氨水是混合溶液;e.熔融KOH是强电解质;f.NH3是非电解质;g.CCl4是有机物,非电解质;h.CO2是非电解质;i.冰醋酸是弱酸,是弱电解质;j.NaHSO4固体是强电解质;
(1)①)当物质中含自由移动的离子或电子时,则物质能导电,故abde能导电,故答案为:abde ;
②在水溶液中和熔融状态下均不能导电的化合物为非电解质,故fgh非电解质,故答案为:fgh;
③在水溶液中或熔融状态下能导电的化合物为电解质,故ceij为电解质,而只有当物质中含自由移动的离子或电子时,则物质能导电,否则不导电,故e熔融KOH能导电,故是电解质但不导电的是cij,故答案为:cij ;
④在水溶液中只能部分电离的电解质为弱电解质,故i为弱电解质,故答案为:i;
⑤CH3COOH是弱酸,只能部分电离,故电离方程式为CH3COOHCH3COO-+H+;硫酸氢钠在水溶液中的电离方程式为:NaHSO4=Na++H++![]() ;
;
(2) 25℃时,pH=8的Ba(OH)2溶液中c(H+)=108mol/L,![]() ,pH=5的稀盐酸中c(H+)=105mol/L,混合后液pH=7,则n(H+)=c(OH),即V[Ba(OH)2]×c(OH)=V(HCl)×c(H+),V[Ba(OH)2]×106mol/L=V(HCl)×105mol/L,所以V[Ba(OH)2]:V(HCl)=10:1;
,pH=5的稀盐酸中c(H+)=105mol/L,混合后液pH=7,则n(H+)=c(OH),即V[Ba(OH)2]×c(OH)=V(HCl)×c(H+),V[Ba(OH)2]×106mol/L=V(HCl)×105mol/L,所以V[Ba(OH)2]:V(HCl)=10:1;
(3) pH均为2的盐酸、硫酸溶液、醋酸溶液,盐酸、硫酸是强电解质,氢离子完全电离,但硫酸是二元酸,故硫酸的浓度小于盐酸,醋酸是弱电解质,不能完全电离,故醋酸的浓度最大,故三种溶液的物质的量浓度依次为c1、c2、c3,则它们之间由小到大的顺序为c2<c1<c3。


科目:高中化学 来源: 题型:
【题目】(15分)含苯酚的工业废水的方案如下图所示:

回答下列问题:
(1)设备①进行的是 操作(填写操作名称),实验室这一步操作所用的仪器是 。
(2)由设备②进入设备③的物质A是 。
(3)在设备③中发生反应的化学方程式为 。
(4)在设备④中,物质B的水溶液和CaO反应,产物是CaCO3、 和水,再通过过滤得产物。
(5)上图中,能循环使用的物质是C6H6、CaO、NaOH水溶液、 。
(6)写出同时满足下列条件的苯酚的一种同分异构体的结构简式是 。
①核磁共振氢谱只有一个峰
②分子中无碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“达菲”是瑞士罗氏公司研制的有效治疗人类禽流感的药物。达菲的主要合成原料是我国盛产的莽草酸。


下列说法不正确的是( )
A.莽草酸可溶于水
B.1 mol莽草酸最多可和4 molNaOH溶液反应
C.从结构上推测,达菲既可与盐酸反应又可与氢氧化钠溶液反应
D.从结构上推测,以莽草酸为原料合成达菲须经过酯化反应等步骤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。
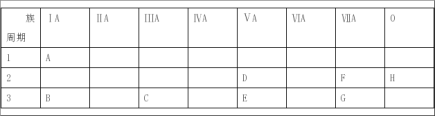
根据A~G元素在周期表中的位置,用化学式填写空白。
(1)单质中氧化性最强的是_______,还原性最强的是_____,化学性质最不活泼的是______。
(2)最高价氧化物对应水化物的酸性最强的酸是_________,最稳定的氢化物是__________。
(3)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、E、G四种元素的最高价氧化物对应水化物的化学式排列成序是________。
(4)D、E、F三种元素按原子半径由大到小的顺序排列为____。
(5)A的氧化物常温下呈____态,它和B的单质反应后所得溶液的pH____7。
(6)B2O2的电子式为______,其中化学键的类型有____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法正确的是
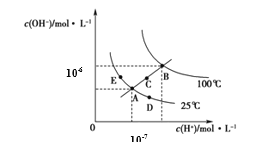
A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到C点,可采用温度不变时在水中加入适量H2SO4 的方法
C.若从A点到D点,可采用在水中加入少量NaOH的方法
D.若处在B点温度时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
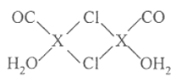
【题目】元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1。在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,原理为:2XCl+2CO+ 2H2O==X2Cl2·2CO·2H2O
(1)X原子基态核外电子排布式为_________;
(2)C、H、O三种元素的电负性由大到小的顺序为________;
(3)H2O中氧原子的轨道杂化类型为__________;
(4)X2Cl2·2CO·2H2O是一种配合物,结构如图所示,每个X原子能与其他原子形成3个配位键,在图中用“→"标出相应的配位键__。CO与N2分子的结构相似,则1molX2Cl2·2CO·2H2O含有δ键的数目为__。
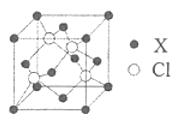
(5)化合物XCl晶体的晶胞如图所示,距离每个X离子最近的Cl的个数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W、M均为短周期主族元素,X与W、M形成的化合物XW2、XM4均为重要的溶剂,25℃时,浓度均为0.1moL·L-1的上述元素的最高价氧化物对应的水化物溶液的pH随原子序数的变化如图所示.
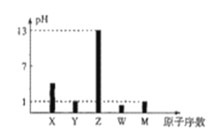
回答下列问题:
(1)M在元素周期表中的位置为___________________.
(2)W可与Z形成化合物Z2W2,写出该物质的电子式:___________________________.
(3)写出一个能说明W与M非金属性强弱的离子方程式:__________________________.
(4)Z的单质可以与X的最高价氧化物反应生成一种盐和黑色固体单质,若每转移1mol电子,恢复至室温时该反应放出QkJ热量,写出该反应的热化学方程式:________________________________________.
(5)M的单质为有毒气体,且在工业上用途广泛,常用Y的简单氢化物检验其运输管道是否漏气,漏气时的现象为产生白烟,该反应中氧化剂与还原剂的物质的量之比为___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中美学者携手发现了全硼富勒烯团簇—B40。B40团簇的结构,酷似中国的红灯笼(如图)。该材料可用于组装分子器件,在储氢储锂、半导体、超导、绿色催化等领域具有重要应用前景。下列有关说法正确的是( )

A.B40与石墨烯的结构相同,二者互为同素异形体
B.43.2g该物质含有2.408×1024个原子
C.B40中既含有极性键又含有非极性键
D.全硼富勒烯团簇是一种新型的高分子材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com