
����Ŀ�����������������߷��ļ��ڣ���������β����ȼúβ�������������ԭ��֮һ��
��1��ʹ�ü״����Ϳ��Լ�������β���Ի�������Ⱦ����ҵ����200���10MPa�������¿��ü��������ͨ��ͭ�ƹܵ���Ӧ�Ƶü״�����֪һ�������£�CH4��CH3OH��ȼ���ȷֱ�784kJ/mol��628kJ/mol��2CH4(g)+O2(g)=2CH3OH(g) ��H=___��
��2��������Ҳ�������Դ���úϳ����ڴ����������Ʊ������ѵķ�Ӧԭ��Ϊ��2CO(g)+4H2(g)CH3OCH3(g) +H2O(g) ��H<0��
��ij�¶��£���2.0molCO(g)��6.0molH2(g)�����ݻ�Ϊ2L���ܱ������У���Ӧ����ƽ��ʱ���ı�ѹǿ���¶ȣ�ƽ����ϵ��CH3OCH3(g)�����ʵ��������仯�����ͼ��ʾ�������¶Ⱥ�ѹǿ�Ĺ�ϵ�ж���ȷ����____��
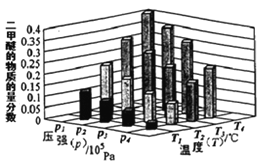
A.P3>P2��T3>T2
B.P1>P3��T1>T3
C.P1>P4��T2>T3
D.P2>P4��T4>T2
���ں����ܱ������ﰴ�����Ϊ1��3����һ����̼���� ����һ�������·�Ӧ�ﵽƽ��״̬�����ı䷴Ӧ��ijһ�����������б仯��˵��ƽ��һ�����淴Ӧ�����ƶ�����___��
A.������ת���ʼ�С B.�淴Ӧ������������С
C.��ѧƽ�ⳣ��Kֵ���� D.��Ӧ�������ٷֺ�������
��3������β����������Ҫԭ��Ϊ��2NO(g)+2CO(g)![]() 2CO2(g) +N2(g)
2CO2(g) +N2(g)
��200K��pPaʱ����һ���ݻ�Ϊ2L�ĺ����ܱ������г���1.5molNO��2.0molCO����ʼ��Ӧ��2minʱ���COת����Ϊ30%������N2��ʾ��ƽ����Ӧ����Ϊ��(N2)=___����Ӧ�ﵽƽ��״̬ʱ����ö�����̼Ϊ0.8mol����ƽ��ʱ��ѹǿΪ��ʼѹǿ��__��(������λС��)��
�ڸ÷�Ӧ�ڵ��������Է����У��÷�Ӧ�Ħ�H__0(����>������<��)
����ijһ���ȡ����ݵ��ܱ������г���һ������NO��CO����������Ӧ���������Ӧ��������ʱ��仯��������ͼ��ʾ(��֪��t2-t1=t3-t2)������˵������ȷ����__(����)
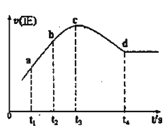
A.��Ӧ��c��δ�ﵽƽ��״̬
B.��Ӧ����a��С��b��
C.��Ӧ��Ũ��a�����b��
D.NO��ת���ʣ�t1~t2 > t2~t3
���𰸡�-312kJ/mol BC BD 0.075mol/(L��min) 0.89 �� D
��������
��1����֪һ�������£�CH4��CH3OH��ȼ���ȷֱ�784kJ/mol��628kJ/mol������CH4(g)+ 2O2(g)=CO2(g)+2H2O(g) ��H1=-784kJ/mol����CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) ��H2=-628kJ/mol�����ݸ�˹���ɣ�����2-����2�ɵã�2CH4(g)+O2(g)=2CH3OH(g) ��H= -312kJ/mol��
O2(g)=CO2(g)+2H2O(g) ��H2=-628kJ/mol�����ݸ�˹���ɣ�����2-����2�ɵã�2CH4(g)+O2(g)=2CH3OH(g) ��H= -312kJ/mol��
��2����ͨ��ͼʾ��֪���¶�Խ�߶����ѵ���������ԽС������ӦΪ���������С�ķ�Ӧ������ѹǿƽ�������ƶ��������ѵ�������������
��A������Ӧ��Ũ�ȣ�ƽ�������ƶ�������Ӧ������������С��
B���淴Ӧ������������С��˵��ƽ�������ƶ���
C����ѧƽ�ⳣ��Kֵ����˵��ƽ�������ƶ���
D����Ӧ�������ٷֺ�������˵��ƽ�������ƶ���
��3���ٸ���COת���ʼ�������CO���ʵ���������v=![]() ����v��CO�����ٸ�������֮�ȵ��ڻ�ѧ������֮�ȼ���v��N2��������Ŀ��Ϣ��֪��
����v��CO�����ٸ�������֮�ȵ��ڻ�ѧ������֮�ȼ���v��N2��������Ŀ��Ϣ��֪��
��������ʽ��2NO(g)+2CO(g)![]() 2CO2(g) +N2(g)
2CO2(g) +N2(g)
��ʼ(mol) 1.5mol 2.0mol 0 0
�仯(mol) 0.8mol 0.8mol 0.8mol 0.4mol
ƽ��(mol) 0.7mol 1.2mol 0.8mol 0.4mol
�������ʵ���֮��=ѹǿ֮�ȿɵã�ƽ��ʱ��ѹǿ����ʼѹǿ=ƽ��ʱ�����ʵ�������ʼ���ʵ�����
������ӦΪ�������ʵ�����С�ķ�Ӧ��Ϊ�ؼ���Ӧ������H-T��S<0��Ӧ�Է����У�
�۴�t4ʱ������Ӧ���ʲ��䣬����ƽ��״̬��t4ʱ��ǰδ����ƽ�⣬��Ӧ������Ӧ���У��ɢ��п�֪Ϊ��Ӧ�ȷ�Ӧ�����������£��淴Ӧ�����¶����ߣ��¶����������ã���Ӧ���ʼӿ죬����Ũ��Ϊ�������أ���Ӧ���ʼ�����ƽ��״̬��
��1����֪һ�������£�CH4��CH3OH��ȼ���ȷֱ�784kJ/mol��628kJ/mol������CH4(g)+ 2O2(g)=CO2(g)+2H2O(g) ��H1=-784kJ/mol����CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) ��H2=-628kJ/mol�����ݸ�˹���ɣ�����2-����2�ɵã�2CH4(g)+O2(g)=2CH3OH(g) ��H= -312kJ/mol��
O2(g)=CO2(g)+2H2O(g) ��H2=-628kJ/mol�����ݸ�˹���ɣ�����2-����2�ɵã�2CH4(g)+O2(g)=2CH3OH(g) ��H= -312kJ/mol��
�ʴ�Ϊ��-312kJ/mol��
��2����2CO(g)+4H2(g) CH3OCH3(g) +H2O(g) ��H<0������Ӧ���ȣ���ͼʾ��֪�¶�Խ�߶����ѵ���������ԽС�����¶ȣ�T1>T2>T3>T4������ӦΪ���������С�ķ�Ӧ������ѹǿƽ�������ƶ��������ѵ�������������ѹǿP1>P2>P3>P4��
�ʴ�Ϊ��BC��
��A������Ӧ��Ũ�ȣ�ƽ�������ƶ�������Ӧ������������С����һ�������ƶ�����A����
B���淴Ӧ������������С��˵��ƽ�������ƶ�����B��ȷ��
C����ѧƽ�ⳣ��Kֵ����˵��ƽ�������ƶ�����C����
D����Ӧ�������ٷֺ�������˵��ƽ�������ƶ�����D��ȷ��
�ʴ�ѡBD��
��3��������CO���ʵ���Ϊ2.0mol��30%=0.6mol��v(CO)= =0.15mol/(L��min)������֮�ȵ��ڻ�ѧ������֮�ȣ���v(N2)=
=0.15mol/(L��min)������֮�ȵ��ڻ�ѧ������֮�ȣ���v(N2)=![]() v(CO)=
v(CO)=![]() ��0.15mol/(L��min)=0.075 mol/(L��min)��
��0.15mol/(L��min)=0.075 mol/(L��min)��
��������ʽ��2NO(g)+2CO(g)![]() 2CO2(g) +N2(g)
2CO2(g) +N2(g)
��ʼ(mol) 1.5mol 2.0mol 0 0
�仯(mol) 0.8mol 0.8mol 0.8mol 0.4mol
ƽ��(mol) 0.7mol 1.2mol 0.8mol 0.4mol
�������ʵ���֮��=ѹǿ֮�ȿɵã�ƽ��ʱ��ѹǿ����ʼѹǿ=ƽ��ʱ�����ʵ�������ʼ���ʵ���=![]() = 0.89����ƽ��ʱ��ѹǿΪ��ʼѹǿ��0.89����
= 0.89����ƽ��ʱ��ѹǿΪ��ʼѹǿ��0.89����
�ʴ�Ϊ��0.075 mol/(L��min)��0.89��
������ӦΪ�������ʵ�����С�ķ�Ӧ��Ϊ�ؼ���Ӧ����S<0������H-T��S<0��Ӧ�Է����У��÷�Ӧ�ڵ��������Է����У��÷�Ӧ����H<0��
�ʴ�Ϊ��<��
�۴�t4ʱ������Ӧ���ʲ��䣬����ƽ��״̬��t4ʱ��ǰδ����ƽ�⣬��Ӧ������Ӧ���У��ɢ��п�֪Ϊ��Ӧ�ȷ�Ӧ�����������£��淴Ӧ�����¶����ߣ��¶����������ã���Ӧ���ʼӿ죬����Ũ��Ϊ�������أ���Ӧ���ʼ�����ƽ��״̬��
A����Ӧ��c��δ�ﵽƽ��״̬����A��ȷ��
B����ͼ��֪����Ӧ����a��С��b�㣬��B��ȷ��
C����Ӧ��Ũ��a�����b�㣬��C��ȷ��
D��NO��ת���ʣ�t1��t2<t2��t3����D����
�ʴ�ѡD��


 �������ϵ�д�
�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ӦX(g)��Y(g)![]() R(g)��Q(g)��ƽ�ⳣ�����¶ȵĹ�ϵ�����ʾ��830 ��ʱ����һ��2 L���ܱ������г���0.2 mol X��0.8 mol Y����Ӧ��ʼ4 s��v(X)��0.005 mol/(L��s)������˵����ȷ����
R(g)��Q(g)��ƽ�ⳣ�����¶ȵĹ�ϵ�����ʾ��830 ��ʱ����һ��2 L���ܱ������г���0.2 mol X��0.8 mol Y����Ӧ��ʼ4 s��v(X)��0.005 mol/(L��s)������˵����ȷ����
�¶�/�� | 700 | 800 | 830 | 1 000 | 1 200 |
ƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
A. 4 sʱ������c(Y)��0.76 mol/L
B. 830 ����ƽ��ʱ��X��ת����Ϊ80%
C. ��Ӧ��ƽ��������¶ȣ�ƽ�������ƶ�
D. 1 200 ��ʱ��ӦR(g)��Q(g) ![]() X(g)��Y(g)��ƽ�ⳣ��K��0.4
X(g)��Y(g)��ƽ�ⳣ��K��0.4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E ������ԭ���������������ǰ������Ԫ�ء�A��B��C��λ��p����ͬһ���ڵ�Ԫ�أ�C�ļ۲�����Ų�Ϊnsnnp2n��A��Cԭ�Ӻ����δ�ɶԵ�������ȣ�DC2��BC2��Ϊ�ȵ����壻EΪ����Ԫ�أ���ԭ�Ӻ���û��δ�ɶԵ��ӡ���ش��������⣺
(1)E�����ڱ��е�λ��_____��
(2)�� Eͬ����ͬ����Ԫ��ԭ�ӵļ۵����Ų�ʽ��_____��C2-�ĵ����Ų�ͼ________��
(3)A��B��C��������Ԫ���γ��⻯����ǵ�����⻯���ȶ�����ǿ����������˳��____ (�����ʽ)��
(4)A��B��C������⻯���У������ɴ�С��˳��Ϊ_____(�÷���ʽ��ʾ)������ B������⻯��� VSEPRģ������Ϊ_____��C������⻯��ķ������幹������Ϊ________��
(5)A��C ����Ԫ�����γɻ����� AC2���÷��ӵĽṹʽ_____������ԭ�ӵ��ӻ��������_________ ,���ݵ������ص���ʽ�IJ�ͬ�������ﹲ�ۼ���������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��˵������ȷ����(����)
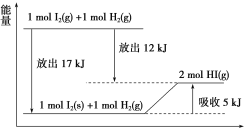
A.1 mol I2(s)��1 mol H2(g)��������2 mol HI(g)ʱ����Ҫ����5 kJ������
B.2 mol HI(g)�ֽ�����1 mol I2(g)��1 mol H2(g)ʱ����Ҫ����12 kJ������
C.1 mol I2(s)��Ϊ1 mol I2(g)ʱ��Ҫ����17 kJ������
D.I2(g)��H2(g)����2HI(g)�ķ�Ӧ�����ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���Һ�У�Na+���ʵ���Ũ�������ǣ�������
A. 4 L��0.5 mol��L-1NaCl��Һ B. 1 L��0.3 mol��L-1Na2SO4��Һ
C. 5 L��0.4 mol��L-1NaOH��Һ D. 2 L��0.15 mol��L-1��Na3PO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz��ֶ�����Ԫ�صĵ��ʼ��仯����(������Һ)��ת����ϵ����֪�ڳ��³�ѹ�£�A�ǹ��壬B��C��D��E�Ƿǽ��������Ҷ������壬C�ʻ���ɫ��������F�ǵ���ɫ���壬������G����ɫ��ӦΪ��ɫ����������Jͨ��״���³���̬��D��E��Ӧ����һ�ִ̼�����ζ�����塣
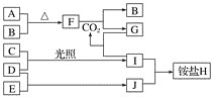
��ش��������⣺
(1)E��J�Ļ�ѧʽ�ֱ���________��________��
(2)д��F��CO2��Ӧ�Ļ�ѧ����ʽ���õ����ŷ���ʾ����ת�Ƶ������_________��
(3)����������Cͨ��ʢ�е��۵⻯����Һ���Թ��У���Һ����ɫ���÷�Ӧ�����ӷ���ʽΪ_________��
(4)�����3.36 L����B��A��ȫ��Ӧ��ת�Ƶ��ӵ���ĿΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�������µĻ�ѧƽ��H2(g)+I2(g)![]() 2HI(g) ��H��0������˵����ȷ���ǣ� ��
2HI(g) ��H��0������˵����ȷ���ǣ� ��
A.���º��ݣ�����H2��v����������ƽ������
B.���º��ݣ�����He��v����������ƽ������
C.��ѹ��v��������v���棩���䣬ƽ�ⲻ�ƶ�
D.���£�v��������С��v���棩����ƽ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£������Ϊ3 L���ܱ������У�һ����̼��������Ӧ���ɼ״�(����ΪCu2O/ZnO)��CO(g)��2H2(g)CH3OH(g)��
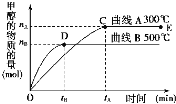
��������������и��⣺
(1)��Ӧ�ﵽƽ��ʱ��ƽ�ⳣ������ʽK��__________�������¶ȣ�Kֵ__________(����������������С������������)��
(2)��500�棬�ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v(H2)��______________��
(3)�������������������£��Դ���E�����ϵ���ѹ����ԭ����1/2�������йظ���ϵ��˵����ȷ����__________(����ĸ���)��
a.������Ũ�ȼ�С b.����Ӧ���ʼӿ죬�淴Ӧ����Ҳ�ӿ�
c.�״������ʵ������� d.����ƽ��ʱn(H2)/n(CH3OH)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ�����ӵ�������ֵ������˵����ȷ���ǣ� ��
A.��״���£�11.2LNO2��ȫ����ˮ��ת�Ƶ�����Ϊ0.5NA
B.20gD2O��HTO����ˮ������к��е�������Ϊ10NA
C.һ���¶��£�1molH2��������������Ӧ������H��I����ĿΪ2NA
D.��״���£�22.4L��HF�к��е�ԭ����ĿΪ2NA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com