
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |

| 实验次数 温度 | 起始温度t1/℃ | 终止温度t2/℃ | 平均温度差(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
分析 Ⅰ、(1)根据公式m=nM=cVM来计算氢氧化钠的质量,但是没有245mL的容量瓶;
(2)根据氢氧化钠具有腐蚀性,吸水性,所以要在玻璃器皿中称量;
Ⅱ、(1)根据中和热的概念书写热化学方程式;
(2)①先判断温度差的有效性,然后求出温度差平均值;
②先根据Q=m•c•△T计算反应放出的热量,然后根据△H=-$\frac{Q}{n}$kJ/mol计算出反应热;
③a.实验装置保温、隔热效果差,热量散失较大;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大;
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大;
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,硫酸的起始温度偏高.
解答 解:Ⅰ、(1)需要称量NaOH固体m=nM=cVM=0.5mol/L×0.25L×40g/mol=5.0g,故答案为:5.0;
(2)氢氧化钠要在称量瓶或者小烧杯中称量,所用的仪器有天平、烧杯和药匙,故答案为:abe;
Ⅱ、(1)中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,若中和热为57.3kJ/mol,则稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol,
故答案为:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
(3)①4次温度差分别为:4.0℃,6.1℃,3.9℃,4.1℃,第3组数据误差较大,舍去,温度差平均值=$\frac{4.0℃+3.9℃+4.1℃}{3}$=4.0℃,故答案为:4.0;
②50mL0.50mol/L氢氧化钠与30mL0.50mol/L硫酸溶液进行中和反应,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为80ml×1g/ml=80g,温度变化的值为△T=4℃,则生成0.025mol水放出的热量为Q=m•c•△T=80g×4.18J/(g•℃)×4.0℃=1337.6J,即1.3376kJ,所以实验测得的中和热△H=-$\frac{1.3376kJ}{0.025mol}$=-53.5 kJ/mol,
故答案为:-53.5kJ/mol;
③a.实验装置保温、隔热效果差,热量散失较大,所得中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,则大于57.3kJ/mol,故b错误;
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd.
点评 本题考查热化学方程式以及反应热的计算,题目难度大,注意理解中和热的概念、把握热化学方程式的书写方法,以及测定反应热的误差等问题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
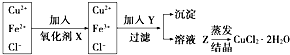 工业上制取纯净的CuCl2•2H2O的主要过程是:
工业上制取纯净的CuCl2•2H2O的主要过程是:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子层序数越大,s原子轨道的形状相同、半径越大 | |
| B. | 在同一电子层上运动的电子,其自旋方向肯定不同 | |
| C. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 | |
| D. | 原子最外层电子排布是5s1的元素,其氢氧化物不能使氢氧化铝溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2溶液中:Cl-、HCO3-、K+、Ba2+ | |
| B. | FeCl3溶液中:K+、NH4+、Br-、SCN- | |
| C. | $\frac{c{(H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、NO3-、K+、Cl- | |
| D. | KMnO4的溶液中:H+、SO42-、CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L的醋酸溶液中c(H+)=0.1mol/L | |
| B. | 0.1mol/L 的NaClO溶液中pH>7 | |
| C. | 任何一个化学变化都伴随着能量的变化 | |
| D. | 新制的氯水中存在着三种分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.2mol/L | B. | 1.5mol/L | C. | 1.6mol/L | D. | 2.0mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 各种物质中的少量杂质 | 试剂 | 方法 |
| A | 苯中的溴 | NaOH溶液 | 分液 |
| B | 乙醇中的乙酸 | 浓硫酸 | 加热 |
| C | 乙酸乙酯中的乙酸 | NaOH溶液 | 分液 |
| D | 甲烷中混有乙烯 | 酸性KMnO4溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L任何气体,其物质的量均为1mol | |
| B. | 非标准状况下,l mol任何气体体积一定不是22.4L | |
| C. | 0.6mol H2、0.2mo1 O2和0.2mol CO2组成的混合气体在标况下体积约22.4L | |
| D. | 气体摩尔体积指的是在标准状况下1mol气体的体积 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com