
【题目】下表列出了A~R 9种元素在周期表中的位置:(用元素符号回答)
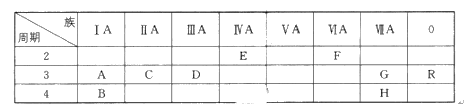
(1)这9种元素其中化学性质最不活泼的是________;
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是_______________;
(3)A、B、C三种元素按原子半径由大到小的顺序排列为________;
(4)F元素氢化物的化学式是________,
【答案】ArAl(OH)3+OH-=AlO2-+2H2OK>Na>MgH2O和H2O2
【解析】
由元素在周期表中的位置可知,A为Na元素,B为K元素,C为Mg元素,D为Al元素,E为C元素,F为O元素,G为Cl元素,H为Br元素,R为Ar元素。
(1)元素周期表中稀有气体元素化学性质最不活泼。
(2)Al(OH)3是一种难溶于水的碱,具有两性,与氢氧化钠溶液反应,生成偏铝酸钠和水。
(3)一般电子层越多,半径越大;电子层相同,原子序数越大半径越小。
(4)氧元素的氢化物有水和过氧化氢两种。
(1)以上几种元素中,稀有气体元素Ar原子最外层为稳定结构,化学性质最不活泼。
(2)D为Al元素,其最高价氧化物对应的水化物为Al(OH)3,与氢氧化钠溶液反应,生成偏铝酸钠和水,离子方程式为:Al(OH)3+OH-=AlO2-+2H2O。
(3)A为Na元素,B为K元素,C为Mg元素,因为同主族元素原子,电子层越多,半径越大,同周期元素原子序数大的半径小,所以原子半径由大到小的顺序排列为K>Na>Mg。
(4)F为O元素,其氢化物为水和过氧化氢,化学式是H2O和H2O2。


科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2) 和亚硫酰氯(SOCl2) 均是重要的化工试剂,遇水发生剧烈反应,常用作脱水剂。
已知:①SO2Cl2 (g)![]() SO2(g)+Cl2(g) △H= +471.7kJ/mol; 平衡常数K1
SO2(g)+Cl2(g) △H= +471.7kJ/mol; 平衡常数K1
②SO2(g) +Cl2(g) +SCl2(g)![]() 2SOCl2(g) △H=-477.3kJ/mol; 平衡常数 K2
2SOCl2(g) △H=-477.3kJ/mol; 平衡常数 K2
(1)反应2SOCl2(g)![]() SO2Cl2(g)+SCl2(g)的平衡常数K=_____(用K1、K2表示) 该反应△H=_____kJ/mol。
SO2Cl2(g)+SCl2(g)的平衡常数K=_____(用K1、K2表示) 该反应△H=_____kJ/mol。
(2)若在绝热、恒容的密闭容器中,投入一定量的SO2Cl2(g)和SCl2(g),发生反应SO2Cl2(g)+SCl2(g)![]() 2SOCl2(g),下列示意图能说明t1时刻反应达到平衡状态的是____(填序号)。
2SOCl2(g),下列示意图能说明t1时刻反应达到平衡状态的是____(填序号)。

(3)为研究不同条件对反应①的影响,在恒温条件下,向2L恒容密闭容器中加入0.2molSO2Cl2,10min后反应①达到平衡。测得10min内v(SO2)= 8.0×10-3mo1·L-1·min-1,则平衡时SO2Cl2的转化率α1=_______。若其它条件保持不变,反应①在恒压条件下进行,平衡时SO2Cl2的转化率α2_____α1(填“>”、“<”或“=”)。若要增大SO2Cl2的转化率,可以采取的措施有______(列举一种)。
(4)锂亚硫酰氯(Li/SOCl2) 电池是一种大容量电池,该电池用锂与石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl4) 溶解在亚硫酰氣(SOCl2)中形成的,其电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S。
①写出电池工作时正极的电极反应式_____________;
②若用此电池做电源,以铂作电极电解200mL 0.2mol.L-1CuSO4溶液,当两极各产生标准状况下896mL的气体时,电池负极消耗锂的质量是______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(g)+bB(s)cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是 ( )
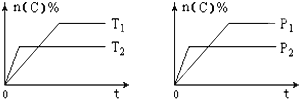
A. P1 > P2
B. 该反应的ΔH < 0
C. 化学方程式系数a>c+d
D. 使用催化剂,C的物质的量分数增加
【答案】B
【解析】A.先拐先平数值大,由右图可知,P2>P1,故A错误;B. 先拐先平数值大,由左图可知,T2>T1,升高温度C的物质的量分数减小,说明升高温度平衡逆向移动,则该反应为放热反应,ΔH < 0,故B正确;C. 由右图可知,P2>P1,增大压强C的物质的量分数减小,说明增大压强平衡逆向移动,则逆反应方向为气体体积减小的方向,所以化学方程式系数a<c+d,故C错误;D. 使用催化剂不能使化学平衡发生移动,则C的物质的量分数不变,故D错误;答案选B。
【题型】单选题
【结束】
22
【题目】25℃时,0.1 molL-1溶液的pH如下表,下列有关说法正确的是 ( )
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A. 酸性强弱:HF<H2CO3
B. ①和②中溶质均未水解
C. 由水电离产生的c(H+):①>②
D. ④溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)= c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子一定能大量共存的是( )
A.含有大量Ba2+的溶液:Cl﹣ K+ SO42﹣ CO32﹣
B.含有大量H+的溶液:Mg2+ Na+ SO42﹣ CO32﹣
C.含有大量 OH﹣的溶液:Cu2+ NO3﹣ SO42﹣ CO32﹣
D.含有大量Na+的溶液:H+ K+ SO42﹣ NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.甲烷中混有少量乙烯可用酸性高锰酸钾溶液除去
B.苯和乙烯都有碳碳双键所以都能使溴水褪色
C.相同质量的乙炔与苯分别在足量的氧气中完全燃烧,消耗氧气的物质的量相同
D.在一定条件下,苯与氯气生成氯苯的反应类型是加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,H2SO3 Ka1=1.5×10-2 Ka2=1.0×10-7 H2CO3 Ka1=4.4×10﹣7 Ka2=4.7×10-11 HClO Ka=3.0×10﹣8 饱和 NaClO 溶液的浓度约为 3mol/L.
(1)室温下,0.1mol/L NaClO 溶液的 pH _____0.1mol/L Na2SO3 溶液的 pH.(选填“大于”、小于”或“等于”)。浓度均为 0.1mol/L 的 Na2SO3 和 Na2CO3 的混合溶液中,SO32﹣、CO32﹣、HSO3﹣、HCO3﹣浓度从大到小的顺序为_______________。
(2)下列离子反应正确的有:__________。
A.2HCO3﹣+SO2═SO32﹣+2CO2+H2O B.ClO﹣+CO2+H2O═HClO+HCO3﹣
C.ClO﹣+SO2+H2O═HClO+HSO3﹣ D.2ClO﹣+SO2+H2O═2HClO+SO32﹣
(3)某消毒液的有效成分为 NaClO,还含有一定量的 NaOH 等,下列用来解释事实的方程式中不合理的是:__________。
A.该消毒液可用 NaOH 溶液吸收 Cl2 制备:Cl2+2OH﹣═Cl﹣+ClO﹣+H2O
B.室温下,该消毒液的 pH 约为12,主要是因为:ClO﹣+H2O![]() HClO+OH﹣
HClO+OH﹣
C.该消毒液加白醋生成 HClO,可增强漂白作用:H++ClO﹣═HClO
D.该消毒液与洁厕灵(主要成分为 HCl)混用,产生 Cl2:2H++Cl﹣+ClO﹣═Cl2↑+H2O
(4)25℃时,0.1mol 下列气体分别与 1L0.l mol·L﹣1 的 NaOH 溶液反应,形成的溶液的pH 由大到小的顺序为:_________(用 A、B、C 表示).
A.SO3 B.SO2 C.CO2
(5)下列说法不正确的是(_____)
A.一定温度下,pH相同的氨水和氢氧化钠等体积混合后溶液pH不变
B.含等物质的量的 NaClO、NaHCO3 混合溶液中:c(HClO)+c(ClO﹣)=c(HCO3﹣)+c(H2CO3)+c(CO32﹣)
C.CH3COOH 溶液加水稀释后,溶液中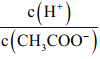 的值减小
的值减小
D.水中加入金属钠,虽反应生成了强碱氢氧化钠,但促进了水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA为阿伏伽德罗常数)( )
A. 58.5g NaCl含有σ键的个数为2NA
B. 12 g石墨中含有C--C键的个数为3NA
C. 12 g金刚石中含有C--C键的个数为2NA
D. 78 g苯中含有C==C键的个数3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气和氮气一定条件下反应生成氨气。已知 H-H 键、N≡N、H-N 键能分别为Q1、Q2 、Q3 kJmol-1。下列关系式中正确的是
A.3Q1 + 3Q2 < 2Q3
B.Q1+Q2 < Q3
C.3Q1 + Q2 < 6 Q3
D.3Q1 + Q2 < 2Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中(假定不考虑水解因素)仅含有K+、Mg2+、SO42﹣、NO3﹣四种离子,其中K+与Mg2+的个数之比为4:5,则NO3﹣与SO42﹣的物质的量浓度之比一定不是( )
A.8:3
B.3:2
C.1:3
D.2:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com