
【题目】下列图示中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物。它们的焰色试验均为黄色。
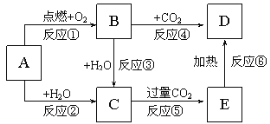
回答下列问题:
(1)写出化学式:A___,D___。
(2)以上反应中不属于氧化还原反应的有___(填序号)。
(3)反应③的离子方程式:___。氧化剂为___;氧化产物为___。
(4)向D溶液中通入CO2反应的化学方程式:____。
【答案】Na Na2CO3 ⑤⑥ 2Na2O2+2H2O=4Na++4OH-+O2↑ Na2O2 O2 Na2CO3+H2O+CO2=2NaHCO3
【解析】
焰色反应为黄色的是钠元素,则A是金属钠,钠在氧气中燃烧生成过氧化钠,过氧化钠与二氧化碳反应生成碳酸钠和氧气,过氧化钠与水反应生成氢氧化钠和氧气,金属钠与水发生置换反应生成氢氧化钠和氢气,氢氧化钠溶液吸收足量的二氧化碳可生成碳酸氢钠,碳酸氢钠热稳定性较差,受热分解转化为碳酸钠。所以,A是钠,B是过氧化钠,C是氢氧化钠,D是碳酸钠,E是碳酸氢钠。以此进行分析解答。
(1)根据以上分析,A为Na,D为Na2CO3,
答案为:Na;Na2CO3;
(2)上述6个反应中①、②、③、④或有单质参加反应,或有单质生成,反应中有元素化合价的变化,这四个反应属于氧化还原反应,则⑤ ⑥两个反应中没有元素化合价的变化,不属于氧化还原反应,
答案为:⑤⑥;
(3)反应③为过氧化钠和水反应生成氢氧化钠和氧气,离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑;该反应中Na2O2既做氧化剂又做还原剂,氧化产物为氧气。
答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;Na2O2;O2;
(4)向碳酸钠溶液中通入CO2生成碳酸氢钠,反应的化学方程式:Na2CO3+H2O+CO2=2NaHCO3,
答案为:Na2CO3+H2O+CO2=2NaHCO3。


 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】(1)标准状况下的甲烷和一氧化碳的混合气体8.96 L,其质量是7.60 g,则混合气体中甲烷的体积为________,一氧化碳的质量为_______。
(2)现有CO、CO2的混合气体,根据下列条件回答问题
①若该混合气体在标准状况下的密度为1.79 g/L,则混合气体中CO的体积分数为__________。
②若标准状况下,2.24 L该混合气体的质量为4 g,则混合气体中CO和CO2的物质的量之比为_________。
(3)一定量的甲烷在O2不足的情况下燃烧,得到CO、CO2和H2O的总质量是7.2 g,若其中水的质量为3.6 g,则CO的质量是_________。
(4)在一定条件下,某固体化合物X受热分解方程式为: 2X = A↑+2B↑+3C↑,测得反应后生成的混合气体对H2的相对密度为11。在相同条件下,X的相对分子质量是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和浓HCl在一定温度下反应会生成黄绿色的易爆物二氧化氯。其反应可表述为:
________KClO3+________HCl(浓) ===________KCl+________ClO2↑+________Cl2↑+________H2O
(1)配平以上化学方程式(写出各物质的化学计量数)。
(2)ClO2是反应的_________(填“氧化”或“还原”)产物。浓盐酸在反应中显示出来的性质是________(填字母)。
a.还原性 b.氧化性 c.酸性 d.碱性
(3)反应产生0.1 mol Cl2,则转移的电子的物质的量为________ mol。
(4)ClO2具有很强的氧化性,因此可被用来做消毒剂,若ClO2作消毒剂后其自身转化为Cl,则其消毒的效率(以单位质量得到电子数表示)是Cl2的________倍(保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程如下图所示:
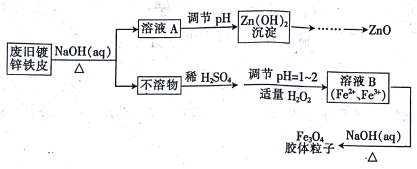
(1)从流程图可知,Zn、Fe中能与NaOH溶液反应的是________。
(2)Zn(OH)2沉淀加热可得ZnO,该反应______(填“是”或“不是”)氧化还原反应。
(3)向不溶物中加入稀H2SO4发生反应的离子方程式是_________。
(4)加入适量H2O2的目的是_________。
(5)如何证明已生成了Fe3O4胶体? _________。
(6)流程中所需的硫酸溶液由焦硫酸(H2SO4·SO3)溶于水配制而成,其中的SO3都转化为硫酸,若将445g焦硫酸溶于水配成4.00L 硫酸,该硫酸的物质的量浓度为__mol/L
(7)稀硫酸也可以用浓硫酸和水配制。已知4mol/L的硫酸溶液密度为ρ1 g/cm3,2mol/L的硫酸溶液密度为ρ2 g/cm3。100g物质的量浓度为4mol/L 的硫酸溶液与___mL水混合,使硫酸的物质的量浓度减小到2mol/L。(用含ρ1、ρ2的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质能导电的是___,属于电解质的是___。
①NaCl晶体 ②液态SO2 ③液态醋酸 ④铜 ⑤BaSO4固体 ⑥纯蔗糖(C12H22O11) ⑦氨水 ⑧熔化的KNO3
(2)0.5molCH4的质量是___g,在标准状况下的体积为___L;
(3)8.4g氮气和9.6g某单质Rx所含原子个数相同,且分子个数之比为3:2,则x的值是___,R的摩尔质量是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里常用Na2O2与H2O反应快速制取少量的O2,下面装置用来制取O2并演示Na在O2中的燃烧实验。
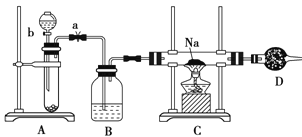
(1)关闭装置中的止水夹a后,开启活塞b,漏斗中液体不断地往下滴,直至全部流入试管。试判断装置是否漏气________(填“漏气”、“不漏气”或“无法确定”),判断理由是_________________。
(2)写出A装置中反应的化学方程式并标出电子得失情况:_____________。
(3)B装置中盛放的试剂是__________________,其作用是____________。
(4)C装置中观察到的现象是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。
利用下图所示装置进行实验。

(1)装置③的作用是______________________________。
(2)装置②中产生ClO2的化学方程式为________________________________。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55 ℃蒸发结晶;②趁热过滤;③______________;④低于60 ℃干燥,得到成品。
(4)装置①、⑤的作用是______________________________。
(5)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作与现象:取少量晶体溶于蒸馏水,___________________________________。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+===2H2O+2I2+Cl-)。将所得混合液配成100 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2+2S2O32-===2I-+S4O62-)。
(6)滴定中使用的指示剂是______________,达到滴定终点时的现象为__________。
(7)样品中NaClO2的质量分数为______________(用含m、c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是天然有机高分子化合物,在相同条件下,G的蒸气密度是E的2倍,它们之间的转化关系如图:
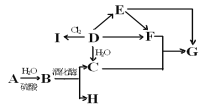
⑴有机物E中官能团的名称是______________________________
⑵检验A水解后是否有B生成,应先中和水解液,再需加入的试剂和反应条件为_________________
⑶已知I的结构中无双键,写出D转化为I的化学方程式____________________________________________
⑷下列说法不正确的是(_________)
A.上图转化关系中有取代反应、加成反应、氧化反应
B.某烃的相对分子质量是D、H之和,该烃可能的结构有三种
C.有机物B、C、D、E均能使酸性高锰酸钾褪色
D.实验室制备G常用饱和碳酸钠溶液收集产物,G在下层
查看答案和解析>>
科目:高中化学 来源: 题型:
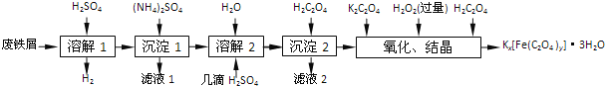
【题目】草酸合铁酸钾晶体Kx[Fe(C2O4)y]·3H2O是一种光敏材料,下面是一种制备草酸合铁酸钾晶体的实验流程。
已知:(NH4)2SO4、FeSO4·7H2O、莫尔盐[(NH4)2SO4·FeSO4·6H2O]的溶解度如表:
温度/℃ | 10 | 20 | 30 | 40 | 50 |
(NH4)2SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
FeSO4·7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | ― |
(NH4)2SO4·FeSO4·6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
(1)废铁屑在进行“溶解1”前,需用在5% Na2CO3溶液中加热数分钟,并洗涤干净。Na2CO3溶液的作用是________。
(2)“溶解1”应保证铁屑稍过量,其目的是___________。“溶解2”加“几滴H2SO4”的作用是________。
(3)“复分解”制备莫尔盐晶体的基本实验步骤是:蒸发浓缩、________、过滤、用乙醇洗涤、干燥。用乙醇洗涤的目的是____________。
(4)“沉淀”时得到的FeC2O4·2H2O沉淀需用水洗涤干净。检验沉淀是否洗涤干净的方法是_______。
(5)“结晶”应将溶液放在黑暗处等待晶体的析出,这样操作的原因是__________。
(6)请补全测定草酸合铁酸钾产品中Fe3+含量的实验步骤[备选试剂:KMnO4溶液、锌粉、铁粉、NaOH溶液:
步骤1:准确称取所制备的草酸合铁酸钾晶体a g,配成250 mL待测液。
步骤2:用移液管移取25.00 mL待测液于锥形瓶中,加入稀H2SO4酸化,_________,C2O42-转化为CO2被除去。
步骤3:向步骤2所得溶液中______________。
步骤4:用c mol·L-1 KMnO4标准溶液滴定步骤3所得溶液至终点,消耗V mL KMnO4标准溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com