



 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol?L-1 H2C2O4溶液 | 30mL 0.01mol?L-1 KMnO4溶液 |
| ② | 20mL 0.2mol?L-1 H2C2O4溶液 | 30mL 0.01mol?L-1 KMnO4溶液 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+>C12>MnO4- |
| B、Fe3+>Cl2>I2 |
| C、I2>Cl2>Fe3+ |
| D、MnO4->Cl2>Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
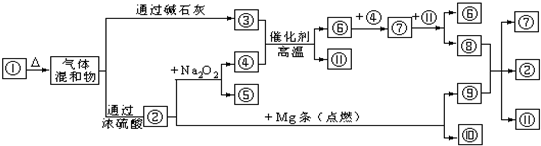
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、b2 mol?L-1?s-1 | ||
B、
| ||
| C、b mol?L-1?s-1 | ||
| D、db2 mol?L-1?s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 同位素 | 相对原子质量 | 丰度(原子分数) |
| 12C | 12(整数,相对原子质量的基准) | 0.9893 |
| 13C | 13.003354826 | 0.0107 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com