
【题目】如图所示原电池的总反应为Cu(s)+2Ag+(aq)===Cu2+(aq)+2Ag(s),下列叙述正确的是

A.电子从银电极经导线流向铜电极
B.盐桥中的阳离子向硝酸银溶液中迁移
C.电池工作时,铜电极发生还原反应
D.将AgNO3溶液更换为Fe(NO3)3溶液,电流表指针反向偏转
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】如下图所示,将两烧杯用导线相连,Pt、Cu、Zn、石墨棒分别为四个电极,当闭合开关后,下列叙述正确的是( )
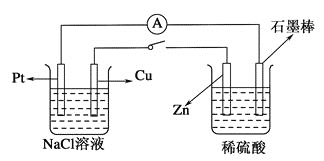
A.Cu极附近![]() 浓度增大
浓度增大
B.Cu极为电解池阳极
C.电子由石墨棒流向Pt极
D.当石墨棒上有![]() 电子转移时,Pt极上有
电子转移时,Pt极上有![]() 生成
生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。

(1)A是铅蓄电池的___________极,铅蓄电池正极反应式为___________,放电过程中电解液的密度___________ (填“减小”、“增大”或“不变”)。
(2)Ag电极的电极反应式是___________,该电极的电极产物共____________g。
(3)Cu电极的电极反应式是____________,CuSO4溶液的浓度____________(填“减小”、“增大”或“不变”)
(4)如图表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示___________。

a.各U形管中产生的气体的体积
b.各U形管中阳极质量的减少量
c.各U形管中阴极质量的增加量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在0.2mol/LAlCl3溶液中,逐滴加入1.0mol/LNaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法正确的( )

A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3OH-=Al(OH)3
B.b点水的电离程度小于a点
C.通过曲线变化,可估计Al(OH)3的溶度积约为1×10-20
D.d点时,溶液中已无沉淀剩余
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 取1mL20%蔗糖溶液,加入适量稀硫酸,水浴加热后取少量溶液,加入几滴新制的Cu(OH)2悬浊液,加热没有砖红色沉淀生成 | 溶液中未出现砖红沉淀 | 蔗糖未水解 |
B | 将C和SiO2的固体混合物加热加热 | 2C+SiO2 | 非金属性:C>Si |
C | 向盛有2mL0.1molL-1的NaCl溶液的试管中逐滴加入几滴0.1molL-1AgNO3溶液,充分反应后,再逐滴加入AgNO3溶液,充分反应后,再逐滴加入0.1molL-1的KI溶液 | 白色沉淀变为黄色沉淀 | Ksp(AgCl)>Ksp(Agl), |
D | 向待测液中加入适量的稀NaOH溶液,将湿润的蓝色石蕊试纸放在试管口 | 湿润的蓝色石蕊试纸未变红 | 待测液中不存在NH4+ |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Hg 是水体污染的重金属元素之一。水溶液中的二价汞的主要存在形态与Cl-、OH-的浓度关系如图所示[图中涉及的物质或粒子只有Hg(OH)2 为难溶物,粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-1gc(Cl-)]:

下列说法中错误的是
A. Hg(NO3)2固体溶于水通常会出现浑浊
B. 海水Cl-的浓度大于0.1mol/L,则其中汞元素的主要存在形态是Hg(OH)2
C. 少量Hg(NO3)2溶于0.001moL/L盐酸后得到澄清透明溶液
D. 已知Ksp(HgS)=1.6×10-52,当c(S2-)=1×10-5mo/L 时,c(Hg2+)=1.6×10-47mo/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学选修:化学与技术某研究性学习小组对某废旧合金(含有Cu、Fe、Si 三种成分)进行分离、回收.其工业流程如图:

已知:298K时,Ksp[Cu(OH)2]=2.0×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ一定都不含有的操作是________
A.过滤 B.洗涤 C.干燥 D.蒸馏
(2)过量的还原剂应是________,溶液a中发生的反应的离子方程式为________;
(3)若用x mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液ymL,则最后所得红棕色固体C的质量为________g(用含x、y的代数式表示).
(4)将溶液c调节pH至2.9-3.2的目的是________;
(5)常温下,取0.2mol/L的CuCl2溶液,若要使Cu2+开始沉淀,应调节pH至________;
(6)工业上由红棕色固体C制取相应单质常用的方法是________
A.电解法 B.热还原法 C.热分解法
(7)用惰性电极电解溶液e制取固体B,所发生的化学反应方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式错误的是( )
A. 实验室制Cl2:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B. 在NaCl溶液中滴入AgNO3溶液:Ag++Cl-===AgCl↓
C. Cl2溶于水:Cl2+H2O===2H++Cl-+ClO-
D. 用NaOH溶液吸收Cl2:Cl2+2OH-===Cl-+ClO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号________________ ,该能层具有的原子轨道数为________________、电子数为________________。
(2)硅主要以硅酸盐、________________等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以________________相结合,其晶胞中共有8个原子,其中在面心位置贡献________________个原子。
(4)单质硅可通过甲硅烷(SiH4) 分解反应来制备。工业上采用Mg2Si和NH4CI在液氨介质中反应制得SiH4,该反应的化学方程式为________________。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:

硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是___________SiH4的稳定性小于CH4,更易生成氧化物,原因是 ________________。
(6)在硅酸盐中,SiO44+四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根;其中Si原子的杂化形式为________________。Si与O的原子数之比为 ________________ 化学式为________.

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com