
| A.原子半径:H<Al<Mg<Na |
| B.热稳定性:HCl<H2S<PH3 |
| C.P、S、Cl元素最高价氧化物对应的水化物酸性依次增强 |
| D.N、O、F元素非金属性依次增强 |
 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源:不详 题型:问答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 四 | ⑩ | (11) | (12) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径的大小取决于原子核外电子层数 |
| B.原子半径的大小取决于核电荷数 |
| C.同周期主族元素,原子半径随原子序数增大而增大 |
| D.同主族元素,原子半径随原子序数减小而减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.P、S、Cl最高正价依次降低 |
| B.钠、镁、铝的还原性依次减弱 |
| C.HCl、HBr、HI的稳定性依次增强 |
| D.HClO4、H2SO4、H3PO4的酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碱性:KOH>NaOH>LiOH |
| B.酸性:HNO3>H3PO4>HClO4 |
| C.还原性:Cl->S2->I- |
| D.稳定性:H2O>HF>H2S |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素编号 | 元素性质或原子结构 |
| W | 原子电子层数与核外电子数相等 |
| X | 原子核外L层上s能级的电子总数为p能级上的电子总数的一半 |
| Y | 元素的原子半径在短周期中最大(除稀有气体外) |
| Z | 原子核外p能级上的电子总数等于s能级上的电子总数 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 键的数目为____ __________________.
键的数目为____ __________________. g/cm
g/cm ,阿伏加德罗常数为
,阿伏加德罗常数为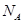 ,求晶胞边长a=________cm。(用含
,求晶胞边长a=________cm。(用含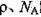 的计算式表示)
的计算式表示)
| A.第一电离能大小:S>P>Si |
| B.电负性顺序:C<N<O<F |
| C.因为晶格能Ca0比KCl高,所以KCl比CaO熔点低 |
| D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 电离能 I1 I2 I3 I4 … |
| In/kJ.mol-1 578 1817 2745 11578 … |
 ,下列叙述正确的有
,下列叙述正确的有  的熔点(填>、=或<),其原因是 。
的熔点(填>、=或<),其原因是 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com