
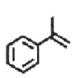
【题目】2-苯基丙烯是日化行业常用的化工原料,其合成路线如下(反应②、④的条件未写出)。
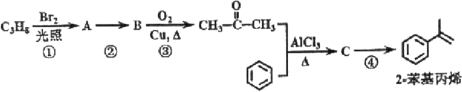
已知: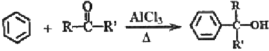
其中,R、R’为H原子或烷基。
(1)C3H8的结构简式为___;
(2)反应①的反应类型为___;
(3)反应②的化学反应方程式为___;
(4)反应③的反应类型为___;
(5)反应④的化学反应方程式为___;
(6)产物2-苯基丙烯在一定条件下可以发生加聚反应,加聚产物的结构简式为___;
(7)请以苯、乙醇及其他必要的无机试剂为原料,合成![]() 。合成过程中,不得使用其他有机试剂。写出相关化学反应方程式___。
。合成过程中,不得使用其他有机试剂。写出相关化学反应方程式___。
【答案】CH3CH2CH3 取代反应 CH3CHBrCH3+NaOH![]() CH3CHOHCH3+NaBr 氧化反应
CH3CHOHCH3+NaBr 氧化反应 ![]()
![]()
 +H2O
+H2O 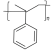 2CH3CH2OH+O2
2CH3CH2OH+O2![]() 2CH3CHO+2H2O,CH3CHO+
2CH3CHO+2H2O,CH3CHO+![]()
![]()
![]() ,
,![]()
![]()
![]() ,
,![]() +HBr
+HBr![]()
![]()
【解析】
C3H8为丙烷,由B与O2、Cu加热发生氧化反应生成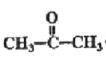 ,可知B为异丙醇,则C3H8与Br2光照发生取代反应,生成的A为2-溴丙烷,2-溴丙烷与NaOH溶液发生取代反应生成异丙醇;由题目中所给信息可知C为2-苯基丙醇,发生消去反应生成2-苯基丙烯,以2-苯基丙烯为单体写出它的加聚产物结构简式;根据题目所给信息和平时所学方程式合成
,可知B为异丙醇,则C3H8与Br2光照发生取代反应,生成的A为2-溴丙烷,2-溴丙烷与NaOH溶液发生取代反应生成异丙醇;由题目中所给信息可知C为2-苯基丙醇,发生消去反应生成2-苯基丙烯,以2-苯基丙烯为单体写出它的加聚产物结构简式;根据题目所给信息和平时所学方程式合成![]() 。
。
C3H8为丙烷,由B与O2、Cu加热发生氧化反应生成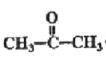 ,可知B为异丙醇,则C3H8与Br2光照发生取代反应,生成的A为2-溴丙烷,2-溴丙烷与NaOH溶液发生取代反应生成异丙醇;由题目中所给信息可知C为2-苯基丙醇,发生消去反应生成2-苯基丙烯,
,可知B为异丙醇,则C3H8与Br2光照发生取代反应,生成的A为2-溴丙烷,2-溴丙烷与NaOH溶液发生取代反应生成异丙醇;由题目中所给信息可知C为2-苯基丙醇,发生消去反应生成2-苯基丙烯,
(1)C3H8为丙烷,结构简式为:CH3CH2CH3,故答案为:CH3CH2CH3;
(2)①的反应类型为取代反应,故答案为:取代反应;
(3)反应②的化学反应方程式为CH3CHBrCH3+NaOH![]() CH3CHOHCH3+NaBr,故答案为:CH3CHBrCH3+NaOH
CH3CHOHCH3+NaBr,故答案为:CH3CHBrCH3+NaOH![]() CH3CHOHCH3+NaBr;
CH3CHOHCH3+NaBr;
(4)③为氧化反应,故答案为:氧化反应;
(5)2-苯基丙醇发生消去反应生成2-苯基丙烯,化学方程式为![]()
![]()
 +H2O,故答案为:
+H2O,故答案为:![]()
![]()
 +H2O;
+H2O;
(6)2-苯基丙烯发生加聚反应,碳碳双键断开,它的加聚产物结构简式为 ,故答案为:
,故答案为: ;
;
(7)乙醇先与O2、Cu加热生成乙醛,乙醛与苯在AlCl3作用下生成1-苯乙醇,1-苯乙醇与浓硫酸加热生成苯乙烯,苯乙烯与HBr加成生成![]() ,相关的化学方程式为:2CH3CH2OH+O2
,相关的化学方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O,CH3CHO+
2CH3CHO+2H2O,CH3CHO+![]()
![]()
![]() ,
,![]()
![]()
![]() ,
,![]() +HBr
+HBr![]()
![]() ,故答案为:2CH3CH2OH+O2
,故答案为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O,CH3CHO+
2CH3CHO+2H2O,CH3CHO+![]()
![]()
![]() ,
,![]()
![]()
![]() ,
,![]() +HBr
+HBr![]()
![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知化合物X由4种元素组成,某学习小组进行了如下实验:
![]()
已知:步骤②中消耗KI0.15mol
请回答:
(1)X的化学式是___,黄色溶液乙与SO2反应的离子方程式是___。
(2)X中一种元素对应的单质,与足量的K2CO3溶液反应得到的产物中含溶液甲中溶质,写出该反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在________(填字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定过程中,眼睛应注视________________。滴定时,用0.2000molL-的盐酸来滴定待测液,不可选用______(填编号字母)作指示剂。
A.甲基橙 B.石蕊 C.酚酞
(3)滴定时,用0.200 0 mol·L-1的盐酸来滴定待测溶液,根据下表数据,计算被测烧碱溶液的物质的量浓度是________ mol·L-1,烧碱样品的纯度是________。
滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(4)下列实验操作会对滴定结果产生什么后果?(填“偏高”、“偏低”或“无影响”)
①若将锥形瓶用待测液润洗,然后加入10.00mL待测液,则滴定结果______
②若锥形瓶未干燥就加入10.00mL待测液,则滴定结果______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国著名有机化学家张绪穆于2000年在JACS杂志上公布了著名的“张烯炔异构化反应”及其机理。该反应丰富了人类进行天然有机分子全合成的手段,该反应原理如下: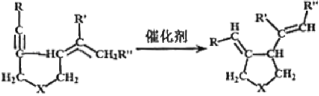
其中:—R、—R’、—R’’可以为—H、—CH3、—CH2CH3或![]() ,—X—可以为—O—、—NH—或CH2—
,—X—可以为—O—、—NH—或CH2—
现拟合成![]() 应选取的反应物是( )
应选取的反应物是( )
A.CH3—C![]() C—CH2—O—CH2—CH=CH—CH3
C—CH2—O—CH2—CH=CH—CH3
B.CH3—C![]() C—CH2—O—CH2—CH2—CH=CH2
C—CH2—O—CH2—CH2—CH=CH2
C.CH3—C![]() C—CH2—O—CH2—CH=CH—CH2—CH3
C—CH2—O—CH2—CH=CH—CH2—CH3
D.CH3—C![]() C—CH2—O—CH2—CH2—CH=CH—CH3
C—CH2—O—CH2—CH2—CH=CH—CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
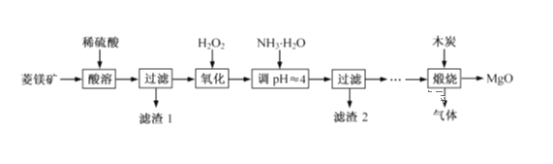
(1)MgCO3与稀硫酸反应的离子方程式为__________________________。
(2)加入H2O2氧化时,发生反应的离子方程式为__________________________。
(3)滤渣2 的成分是____________(填化学式),过滤分离需要的玻璃仪器有 __________________。
(4)煅烧过程存在以下反应:
2MgSO4+C=2MgO+2SO2↑+CO2↑
MgSO4+C=MgO+SO2↑+CO↑
MgSO4+3C=MgO+S↑+3CO↑
利用图装置对煅烧产生的气体进行分步吸收或收集。
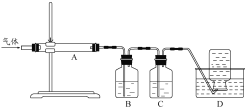
D中通过排水法收集的气体可以是___________(填化学式)。C中溶液用于吸收CO2,B中盛放的溶液可以是___________(填字母)。
a.NaOH 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
(5)A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+、AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+,若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是(填字母)_____。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是(填字母编号)_____________。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI-淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出该反应的离子方程式:________________________。
(4)用离子方程式表示NaNO2溶液显碱性的原因________________。
(5)若FeSO4和O2的化学计量数比为2:1,试配平下列方程式:
___FeSO4+__K2O2-__K2FeO4+__K2O+__K2SO4 +__O2↑
每产生1molO2转移的电子数目为____________。
(6)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,发挥的作用是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)钢铁容易生锈的主要原因是钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。在酸性环境下,其正极反应式为_____________;在酸性很弱或中性条件下,其发生___________________ (填“析氢腐蚀”或“吸氧腐蚀”)。
(2)利用如图装置,可以模拟铁的电化学防护。若X为碳棒,开关K置于N处,该电化学防护法称为____________________;若X为锌棒,开关K置于M处,________(填“能”或“不能”)达到防止铁腐蚀![]() 目的。
目的。
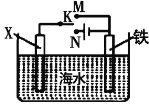
II.如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,完成下列问题:

(1)甲池燃料电池的负极反应为___________________。
(2)乙池中石墨电极为___________极,发生_____________反应(填“氧化”或“还原”)写出乙池中电解总反应的化学方程式: ___________________。
(3)甲池中消耗224mL(标准状况下)O2,此时丙池中理论上最多产生________g沉淀,此时乙池中溶液的体积为400mL,该溶液的pH=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对下列实验现象表述不正确的是
A. 用同一针筒先后抽取80 mL氯气、20 mL水,振荡,气体完全溶解,溶液变为黄绿色
B. 在表面皿中加入少量胆矾,再加入3 mL浓硫酸,搅拌,固体由蓝色变白色
C. 向二氧化硫水溶液中滴加氯化钡溶液,再滴加双氧水,产生白色沉淀
D. 将点燃后的镁条伸入充满二氧化碳的集气瓶,镁条剧烈燃烧,有白色、黑色固体生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是( )
A.由水电离产生的c(H+)=1x10-13 mol/L的溶液中:Na+、K+、Cl-、SO42-
B.室温下,pH=1的盐酸中:Na+、Fe2+、NO3-、SO42-
C.含有Ca2+的溶液中:Na+、K+、CO32-、Cl-
D.常温下在KW/ c(OH-)=10-12的溶液中:K+、Al3+、Cl-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com