
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |

分析 本题是利用湿法、干法制备高铁酸盐的原理的探究,涉及反应原理、氧化还原反应分析、利用溶度积的计算等,其中制备高铁酸盐是利用NaClO在碱性条件下的强氧化性将Fe3+氧化成FeO42-,NaClO可通过氯气溶于NaOH溶液得到,制得的高铁酸盐有强氧化性可做水的消毒剂,且其还原产物水解后得到的胶体能吸附悬浮物,可净化水,根据氧化还原的反应可得到制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为;
(1)①反应Ⅰ根据氯气的化学性质,可写出与氢氧化钠溶液反应的化学方程式;
②反应Ⅱ:根据目标产物可知,Fe3+要被溶液里的ClO-在碱性条件下氧化成高铁酸盐,可结合氧化还原反应的理论写出此反应的离子方程式;
③25℃时Fe(OH)3的Ksp=c(Fe3+)×c(OH-)3,将c(Fe3+)=4×10-5mol•L-1代入可计算出c(OH-),可得溶液的pH;
(2)高铁酸钾具有很强的氧化性,能杀菌消毒,在水中生成的Fe(OH)3胶体,有吸附性;
(3)根据化合价的升降来判断,化合价升高的为还原剂,化合价降低的为氧化剂,并根据化学计量数来分析氧化剂和还原剂的比例;
(4)由图可知高铁电池比高能碱性电池放电时间长,工作电压稳定;
解答 解:(1)①反应Ⅰ为氯气溶解于氢氧化钠溶液,发生歧化反应,化学方程式为2NaOH+Cl2═NaCl+NaClO+H2O,故答案为:2NaOH+Cl2═NaCl+NaClO+H2O;
②反应Ⅱ为氧化还原反应,+3价铁被氧化成+6价铁,+1价的氯被氧化为-1价,反应的环境为碱性,化学方程式为3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O,故答案为:3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O;
③已知Ksp=c(Fe3+)×c(OH-)3=4.0×10-38,溶液中c(Fe3+)=4×10-5mol•L-1时,c(OH-)=$\root{3}{\frac{4.0×1{0}^{-38}}{4×1{0}^{-5}}}=1{0}^{-11}mol/L$,此时溶液中的c(H+)=$\frac{1×1{0}^{-14}}{1{0}^{-11}}$mol/L=10-3mol/L,溶液的pH=3,故答案为:3;
(2)高铁酸钾具有很强的氧化性,能杀菌消毒,在水中被还原得到Fe3+,水解生成Fe(OH)3胶体,有吸附性,故答案为:高铁酸钾有强氧化性,能杀菌消毒,在水中被还原生成Fe(OH)3胶体、有吸附性起净水作用;
(3)干法制备K2FeO4的反应的方程式为:Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O,N元素化合价降低,是氧化剂,铁的化合价降低,是还原剂,氧化剂与还原剂的物质的量之比为3﹕1,故答案为:3﹕1;
(4)由图可知高铁电池比高能碱性电池放电时间长,工作电压稳定,故答案为:放电时间长、工作电压稳定.
点评 实验方案设计与评价是高考不变的一个题型,每年高考必考,是热点题型、也是高考难点之一.本题主要考查了氧化还原反应和离子反应方程式的书写、化学平衡的移动、胶体的净水原理.重点是利用化合价的升价和化学计量数判断氧化剂和还原剂的比例和有关溶度积的计算.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
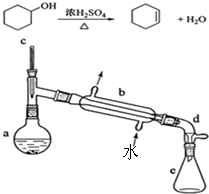 实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如图:
实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如图:| 相对分子数量 | 密度 | 沸点 | 溶解性 | |
| 环乙醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环乙烯 | 82 | 0.8102 | 83 | 难溶于水 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 2.00 | 1.16 | 0.80 | 0.80 | 0.96 | 0.96 |
| N2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
| CO2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50 s 的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol•L-1,则反应的H<0 | |
| C. | 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反应达到平衡前 v(正)>v(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3 的转化率小于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)( )
下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)( )| a | b | c | d | |
| ① | Si | SiO2 | H2SiO3 | Na2SiO3 |
| ② | N2 | NO | NO2 | HNO3 |
| ③ | Cu | CuO | Cu(OH)2 | CuSO4 |
| ④ | Na | NaCl | Na2CO3 | NaHCO3 |
| A. | ①② | B. | ②③ | C. | ③④ | D. | ② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com