
【题目】下列物质能与金属镁发生反应,并产生氢气的是( )
A.氯化铵溶液
B.氢氧化钠溶液
C.热的苯
D.热的无水乙醇
科目:高中化学 来源: 题型:
【题目】向 50mL 稀 H2SO4 与稀 HNO3 的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标 准状况下)之间的关系如图所示,且每一段只对应一个反应。下列说法正确的是( )

A. 参加反应铁粉的总质量 m2=5.6 g
B. 所用混合溶液中 c(HNO3)=0.5 molL-1
C. 开始时产生的气体为 H2
D. AB 段产生的反应为置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)已知反应CO(g)+2H2(g)![]() CH3OH(g) ΔH=-99kJ·mol-1中的相关化学键能如下:
CH3OH(g) ΔH=-99kJ·mol-1中的相关化学键能如下:

则x=______________________。
(2)甲醇作为一种重要的化工原料,既可以作为燃料,还可用于合成其它化工原料。在一定条件下可利用甲醇羰基化法制取甲酸甲酯,其反应原理可表示为:CH3OH(g) +CO(g) ![]() HCOOCH3(g) ΔH=-29.1kJ·mol-1。向体积为2L的密闭容器中充入2mol CH3OH(g) 和2mol CO,测得容器内的压强(p:kPa)随时间(min)的变化关系如下图中Ⅰ、Ⅱ、Ⅲ曲线所示:
HCOOCH3(g) ΔH=-29.1kJ·mol-1。向体积为2L的密闭容器中充入2mol CH3OH(g) 和2mol CO,测得容器内的压强(p:kPa)随时间(min)的变化关系如下图中Ⅰ、Ⅱ、Ⅲ曲线所示:

①Ⅱ和Ⅰ相比,改变的反应条件是____________________。
②反应Ⅰ在5min时达到平衡,在此条件下从反应开始到达到平衡时速率v(HCOOCH3)=__________。
③反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ) =__________。在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入1mol CO和2mol HCOOCH3后v(正)_____v(逆)(填“﹥”“﹤”“﹦”),原因是_________________。
④比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1______T3(填“﹥”“﹤”“﹦”),判断的理由是________________。
(3)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2。某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图所示,利用以下反应填空:
2NO+2CO![]() N2+ 2CO2(有CO) 2NO
N2+ 2CO2(有CO) 2NO![]() N2+ O2(无CO)
N2+ O2(无CO)

①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为____________________。
②在n(NO)/n(CO)=1的条件下,应控制的最佳温度在___左右.
A.670K B.770K C.870K D.970K.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有三种有机物的分子式均为C8H8,其键线式分别表示为X:![]() ,Y:
,Y:![]() ,Z:
,Z:![]() 。下列说法正确的是
。下列说法正确的是
A. X、Z分子中所有原子一定在同一平面内
B. X、Y、Z都能发生取代反应、加成反应和氧化反应
C. X、Y、Z互为同分异构体,它们二氯代物的同分异构体数目不相同
D. X、Y、Z都能使酸性高锰酸钾溶液褪色,也能使溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是—种极强的氧化剂,常应用于饮用水处理,其工业制备方法如图所示:

(1)高铁酸钾中铁元素的化合价是__________价。
(2)反应I的目的是________________________________。
(3)反应II的离子方程式为________________________________。
(4)洗涤粗品时选用乙醇而不用水的理由是________________________________。
(5)己知生成高铁酸钾的反应为Na2FeO4+2KOH![]() K2FeO4↓+2NaOH,请你解释加入饱和KOH溶液能生成高铁酸钾的理由是_________________________。
K2FeO4↓+2NaOH,请你解释加入饱和KOH溶液能生成高铁酸钾的理由是_________________________。
(6)为了提高生活用水的卫生标准,自来水厂常使用高铁酸钾(K2FeO4)进行消毒、净化以及改善水质,其消毒原理是______________________。
(7)可用亚铬酸盐滴定法测定高铁酸钾含量,滴定时有关反应的离子方程式为:
①FeO42-+CrO2-+2H2O==CrO42-+Fe(OH)3↓+OH-
②2CrO42-+2H+=CrO72-+H2O
③CrO72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
现称取2.084g高铁酸钾样品溶于适量NaOH溶液中,加入稍过量的NaCrO2,充分反应后过滤,滤液在250mL容量瓶中定容。每次取25.00mL加入稀硫酸酸化,用0.1000mol·L-1的FeSO4标准溶液滴定,三次滴定消耗标准溶液的平均体积为20.00mL。则上述样品中K2FeO4 的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校研究性学习小组,探究一定量的浓硫酸与足量锌充分反应产生的气体产物,进行如下实验:按图组装好实验装置,在A中加入5 mL 98%的浓硫酸和足量的锌粒,微热试管A,观察到C、D、E中均有气泡产生;随后气泡量减少,品红溶液褪色,D中先出现浑浊后浑浊消失;反应较长时间后,C、D、E中的气泡量又会明显增加。

试回答:
(1)从装置A进入装置B中的气体可能有:______、_________、______。
(2)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接____、____接b,c接____、____接d;D、E两支试管中CCl4溶液的作用是_________________。
(3)能证明浓硫酸具有强氧化性的实验现象为__________________________;
(4)D中浑浊消失的离子反应方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图与表述一致的是
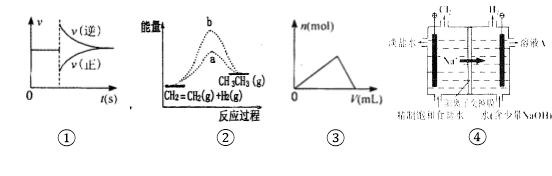
A.图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化
B.图②b曲线表示反应CH2=CH2(g)+H2(g)→CH3-CH3(g)ΔH <0,使用催化剂时,反应过程中的能量变化
C.曲线图③可以表示向一定量的氢氧化钠溶液中滴加一定浓度氯化铝溶液时产生沉淀的物质的量变化
D.图④电解饱和食盐水的装置中阴极的电极反应式为:2H++ 2e- = H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com