
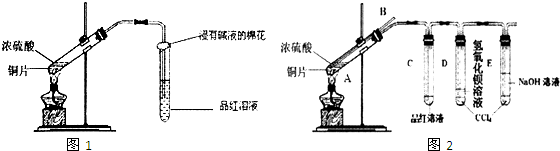
某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4 g 铜片和含0.2 moL溶质的18.4 mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止。(假定在此过程溶液体积不变)

(1)甲同学认为要证实上述结论,还应进行稀硫酸与铜片混合加热实验,你认为有无必要,并说明理由:________________
(2)下列试剂中能够用来进一步证明反应结束后的烧瓶中确有余酸的是:_____
A.铁粉 ?????? B.钠 ???? ?? C.氯化钡溶液 ???????? D.银粉
(3)为定量测定余酸的物质的量浓度,甲、乙两位同学进行了如下设计:
Ⅰ甲同学设想:在A装置增加一个导管通氮气驱赶气体(假定生成的气体全部逸出),先测定生成的SO2的量,然后计算剩余硫酸的浓度。他设计了如下二种方案来测定SO2的量:
方案① 将产生的气体缓缓通入足量用稀硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀。
方案② 将气体缓缓通入足量硝酸钡溶液中,然后过滤、洗涤、干燥、称量沉淀。
经仔细分析后,发现有不合理之处,请填写下表(可以不填满):
序号 | 不合理的原因 | 误差 (偏低或偏高) | 改变措施 |
方案① |
|
|
|
方案② |
|
|
|
Ⅱ乙学生设计的方案是:分离出反应后的溶液并加蒸馏水稀释至1000 mL,取20.00 mL于锥形瓶中,滴入2~3滴酚酞指示剂,用标准NaOH溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),这种方法能否求出余酸的浓度,理由是_______________________________________。
(4)请再设计其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算,不必写操作细节)_____________________________________________________。
(1)无必要,随着反应的进行,浓硫酸变成稀硫酸,稀硫酸与铜不反应。? (2)A
(3)I
方案序号 | 不合理的原因 | 误差(偏低或偏高) | 改变措施 |
方案① | 高锰酸钾溶液中含有硫酸,与氯化钡反应,使生成的沉淀增多 | 偏低 | 将硫酸酸化的高锰酸钾溶液换成溴水或碘水或硝酸溶液 |
方案② | -- | -- | -- |
Ⅱ.不能,PH>5时,Cu2+会与碱反应生成沉淀,不能达到滴定终点。
(4)方案一:①取反应后溶液,向其中加入足量锌;②收集并测定氢气的体积;③通过氢气量计算剩余硫酸的物质的量浓度
方案二:反应结束后将烧瓶中的铜片取出,洗净、烘干,称其质量即可
方案三:反应结束后将烧瓶中的铜片取出,然后向溶液中加入足量氯化钡溶液,过滤出沉淀,洗净、干燥后称量。
【解析】
试题分析:(1)开始是能硫酸与Cu发生反应:Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O。随着反应的进行。硫酸逐渐变稀。稀硫酸与铜片不发生反应。反应后的溶液中含有CuSO4、H2O及过量的H2SO4。要证明反应结束后的烧瓶中确有余酸,A.加入Fe粉会发生反应:CuSO4+Fe= FeSO4+Cu; H2SO4+Fe= FeSO4+H2↑.会有气体产生,因此会冒出气泡。正确。B.由于溶液中含有大量的水,无论酸是否有剩余,都会发生反应:2Na+2H2O=2NaOH+H2↑。因此不能证明酸剩余。错误。C.溶液中含有CuSO4,一定会发生反应:Ba2++SO42-=BaSO4↓。不能证明酸剩余。错误。D.在金属活动性顺序表中Ag位于H后面,不能把酸中的氢置换出来。错误。因此选项为A。(3)I、方案①中KMnO4溶液酸化是用的硫酸,因此在高锰酸钾溶液中的SO42-包括SO2氧化产生的和外加的两部分,这样产生的硫酸钡沉淀就偏多,导致剩余的硫酸偏少(或偏低)。改变的措施是采用其它的氧化剂如溴水或碘水或硝酸溶液等氧化SO2,使其转化为硫酸,再用氯化钡溶液减小滴定。方案②设计合理、操作无误。Ⅱ、用标准NaOH溶液滴定剩余硫酸时,由于在溶液中含有CuSO4,用酚酞作指示剂,变色点为8,但氢氧化铜开始沉淀的pH约为5。Cu2+也会与碱反应生成沉淀,不能达到滴定终点。无法准确测定剩余硫酸的物质的量的多少。(4)其他可行的用来测定余酸的物质的量浓度实验方案可以是方案一:①取反应后溶液,向其中加入足量锌;②收集并测定氢气的体积;③通过H2量计算剩余硫酸的物质的量浓度。方案二:反应结束后将烧瓶中的铜片取出,洗净、在N2的环境中烘干,称其质量即可。方案三:反应结束后将烧瓶中的铜片取出,然后向溶液中加入足量氯化钡溶液,过滤出沉淀,洗净、干燥后称量。根据反应消耗的Cu的质量科确定由CuSO4产生的沉淀的质量。进而计算出剩余酸的物质的量。在这三种方案中第三种方案可操作性更强,误差更小。第二种方法中要在惰性气体或N2的环境中进行不容易进行。而第一种方法H2的体积测量容易引起误差,而且不容易换算为标准状况下。容易产生误差。
CuSO4+SO2↑+2H2O。随着反应的进行。硫酸逐渐变稀。稀硫酸与铜片不发生反应。反应后的溶液中含有CuSO4、H2O及过量的H2SO4。要证明反应结束后的烧瓶中确有余酸,A.加入Fe粉会发生反应:CuSO4+Fe= FeSO4+Cu; H2SO4+Fe= FeSO4+H2↑.会有气体产生,因此会冒出气泡。正确。B.由于溶液中含有大量的水,无论酸是否有剩余,都会发生反应:2Na+2H2O=2NaOH+H2↑。因此不能证明酸剩余。错误。C.溶液中含有CuSO4,一定会发生反应:Ba2++SO42-=BaSO4↓。不能证明酸剩余。错误。D.在金属活动性顺序表中Ag位于H后面,不能把酸中的氢置换出来。错误。因此选项为A。(3)I、方案①中KMnO4溶液酸化是用的硫酸,因此在高锰酸钾溶液中的SO42-包括SO2氧化产生的和外加的两部分,这样产生的硫酸钡沉淀就偏多,导致剩余的硫酸偏少(或偏低)。改变的措施是采用其它的氧化剂如溴水或碘水或硝酸溶液等氧化SO2,使其转化为硫酸,再用氯化钡溶液减小滴定。方案②设计合理、操作无误。Ⅱ、用标准NaOH溶液滴定剩余硫酸时,由于在溶液中含有CuSO4,用酚酞作指示剂,变色点为8,但氢氧化铜开始沉淀的pH约为5。Cu2+也会与碱反应生成沉淀,不能达到滴定终点。无法准确测定剩余硫酸的物质的量的多少。(4)其他可行的用来测定余酸的物质的量浓度实验方案可以是方案一:①取反应后溶液,向其中加入足量锌;②收集并测定氢气的体积;③通过H2量计算剩余硫酸的物质的量浓度。方案二:反应结束后将烧瓶中的铜片取出,洗净、在N2的环境中烘干,称其质量即可。方案三:反应结束后将烧瓶中的铜片取出,然后向溶液中加入足量氯化钡溶液,过滤出沉淀,洗净、干燥后称量。根据反应消耗的Cu的质量科确定由CuSO4产生的沉淀的质量。进而计算出剩余酸的物质的量。在这三种方案中第三种方案可操作性更强,误差更小。第二种方法中要在惰性气体或N2的环境中进行不容易进行。而第一种方法H2的体积测量容易引起误差,而且不容易换算为标准状况下。容易产生误差。
考点:考查实验方案的设计与评价及误差分析的知识。


科目:高中化学 来源: 题型:阅读理解
 “白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
“白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
| ||
| 2S×7.14 |
| ||
| 2S×7.14 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 Al(OH)3+3H+,Cu2++2H2O
Al(OH)3+3H+,Cu2++2H2O Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑
Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑ Al(OH)3+3H+,Cu2++2H2O
Al(OH)3+3H+,Cu2++2H2O Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑
Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑| 选项 | 铝电极 | 电解质 | 负极反应 | 正极反应 |
| A | 正极 | NaOH | Al-3e-=Al3+ | 2H2O+2e-=2OH-+H2↑ |
| B | 负极 | 稀盐酸 | 2Al-6e-=2Al3+ | 6H++6e-=3H2↑ |
| C | 正极 | 浓硝酸 | Cu-2e--=Cu2+ | 2NO3-+4H+-4e-=2NO2↑+2H2O |
| D | 负极 | 稀硝酸 | Cu-2e-=Cu2+ | 2NO3-+8H+=2NO↑+4H2O+6e- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 溶解度(g/100水) | 物质 | 溶解度(g/100水) |
| Ca(OH)2 | 0.173 | Ba(OH)2 | 3.89 |
| CaCO3 | 0.0013 | BaSO3 | 0.016 |
| Ca(HCO3)2 | 16.60 |
| 实验方案 | 现象 |
| 1.取少量溶液于试管中,加入稀盐酸,加热, 用湿润的蓝色石蕊试纸检验生成的气体. |
|
| 2.取少量溶液于试管中,加入 |
查看答案和解析>>
科目:高中化学 来源: 题型:
为了从含有 FeCl3、FeC12、CuC12 的废液中回收Cu,某研究性学习小组的同们设计了两种方案:
方案1 :向废液中加入过量的铁粉,充分反应后,过滤。 在所得滤渣中加入足量的盐酸,充分反后,再过滤即得到铜。
方案1中涉及的四种阳离子的氧化牲由强到弱的顺序为:_____________________过滤操作时,需要用到的玻璃仪器是:______________________
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的Cu已全部析出。
方案2中铜作______极,所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出)_______________________________________________________ 另一电极所发生的电极反应为_____________________________ 方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,主要表现为: ______________________
查看答案和解析>>
科目:高中化学 来源: 题型:

(1)简述该装置气密性的检验方法:_________________________________________________。
(2)滴加硫酸和浓NaOH溶液的顺序是______________________________________________。
(3)实验过程中长胶头滴管外缠绕的滤纸片的变化现象是______________________________。
(4)A瓶中盛放的试剂是__________________________________________________________。
(5)B瓶的作用是_________________________________________________________________。
(6)有同学说,该实验不能完全到达实验目的,其理由是______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com