
| 第一电离能 | 电负性 | 晶格能 | 沸点 |
| Mg | O | MgO | H2O |
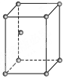 ,镁晶体的堆积方式为六方最密堆积,属于镁型,空间利用率为74%,
,镁晶体的堆积方式为六方最密堆积,属于镁型,空间利用率为74%,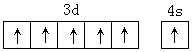 ,
, .
.


科目:高中化学 来源: 题型:
| A、开发利用可燃冰是缓解能源紧缺的唯一途径 |
| B、无论是风力发电还是潮汐发电,都是将化学能转化为电能 |
| C、推广燃煤脱硫技术,可以防治SO2污染 |
| D、生物质能、风能、太阳能等属不可再生资源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验事实 | 结论 | |||||
| ① | CO2的水溶液可以导电 | CO2是电解质 | ||||
| ② | 工业制取粗硅的反应为:2C+SiO2
| 非金属性:C>Si | ||||
| ③ | CO2通入NaSiO3溶液中产生白色沉淀 | 酸性:H2CO3>H2SiO3 | ||||
| ④ | 二氧化硫通入酸性KMnO4溶液中,溶液褪色 | SO2具有漂白性 | ||||
| ⑤ | 某无色溶液中加入BaCl2溶液产生白色沉淀,再加入过量的稀盐酸,沉淀不溶解 | 该溶液中一定有SO42- |
| A、只有③ | B、②③⑤ |
| C、③④⑤ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
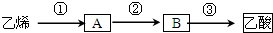
查看答案和解析>>
科目:高中化学 来源: 题型:
| 应加入的物质 | 所起的作用 | |
| A | ||
| B | ||
| C | ||
| D |
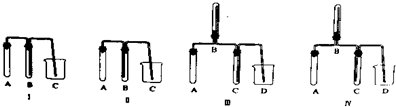
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 容器体积/L | 温度/℃ |
| ① | 2.0 | 1200 |
| ② | 2.0 | 1300 |
| ③ | 1.0 | 1200 |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com