
【题目】国际能源期刊报道了一种正在开发中的绿色环保“全氢电池”,有望减少废旧电池产生的污染。其工作原理如图所示。下列说法正确的是
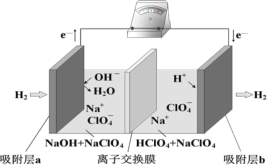
A.“全氢电池”工作时,将酸碱反应的中和能转化为电能
B.吸附层 b 发生的电极反应:H2 – 2 e+ 2OH= 2H2O
C.NaClO4 的作用是传导离子和参与电极反应
D.“全氢电池”的总反应: 2H2 + O2 =2H2O
【答案】A
【解析】
由电子流向可知,左边吸附层为负极,发生了氧化反应,电极反应是H2-2e-+2OH-═2H2O,右边吸附层为正极,发生了还原反应,电极反应是2e-+2H+═H2,结合原电池中阳离子移向正极,阴离子移向负极解答该题。
A. “全氢电池”工作时,将酸碱反应的化学能(中和能)转化为电能,故A正确;
B. 右边吸附层为正极,发生了还原反应,电极反应是2e-+2H+═H2,故B错误;
C. NaClO4 的作用是传导离子,没有参与电极反应,故C错误;
D. 由电子流向可知,左边吸附层为负极,发生了氧化反应,电极反应是H2-2e-+2OH-═2H2O,右边吸附层为正极,发生了还原反应,电极反应是2e-+2H+═H2,总反应为:H++OH-═H2O,故D错误;
正确答案是A。


科目:高中化学 来源: 题型:
【题目】丁香油酚的结构简式如图所示,从它的结构简式可推测它不可能有的化学性质是 ( )
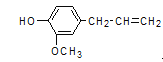
A. 既可燃烧,也可使酸性KMnO4溶液褪色
B. 可与NaHCO3溶液反应放出CO2气体
C. 可与FeCl3溶液发生显色反应
D. 既可与Br2发生加成反应又可发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于取代反应的是
A. CH2=CH2 + H2O![]() CH3CH2OH
CH3CH2OH
B. ![]() +Br2
+Br2![]()
![]() +HBr
+HBr
C. 2CH3CH2OH![]() C2H5—O—C2H5 + H2O
C2H5—O—C2H5 + H2O
D. ![]() +HNO3
+HNO3![]()
![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯气相直接水合反应制备乙醇:C2H4(g)+H2O(g) ![]() C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L)。下列分析不正确的是( )
C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L)。下列分析不正确的是( )

A.乙烯气相直接水合反应的H<0
B.图中压强的大小关系为:p1>p2>p3
C.图中a点对应的平衡常数K =![]()
D.达到平衡状态a、b所需要的时间:a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外研究性学习小组用下图所示装置制备少量溴苯并验证溴与苯的反应是取代反应。
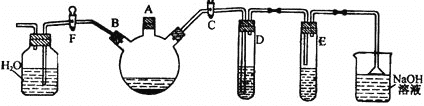
实验时,关闭F活塞,打开C活塞,在装有少量苯的三口烧瓶中由A口加入少量液溴,再加入少量铁屑,塞住A口。回答下列问题:
(1)三口烧瓶中发生的化学反应方程式为_______。
(2)D试管内装的是CCl4溶液,其作用是_______。
(3)除去溴苯中混有的Br2杂质的试剂是______,操作方法为:___,有关化学方程式________。
(4)反应完毕后,试管E(AgNO3溶液)中有___(填现象)生成,说明这种获得溴苯的反应属于_______反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在CuCl2溶液中存在如下平衡:[CuCl4]2-(绿色)+4H2O![]() [Cu(H2O)4]2+(蓝色)+4Cl-,下列说法中不正确的是 ( )
[Cu(H2O)4]2+(蓝色)+4Cl-,下列说法中不正确的是 ( )
A. 将CuCl2固体溶于少量水中得到绿色溶液
B. 将CuCl2固体溶于大量水中得到蓝色溶液
C. [CuCl4]2和[Cu(H2O)4]2+都是配离子
D. 从上述平衡可以看出[Cu(H2O)4]2+比[CuCl4]2稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeSO4 溶液放置在空气中容易变质,因此为了方便使用 Fe2+,实验室中常保存硫酸亚铁铵晶体[俗称“摩尔盐”,化学式为(NH4)2Fe(SO4)26H2O],它比绿矾或绿矾溶液更稳定。(稳定是指物质放置 在空气中不易发生各种化学反应而变质)
I.硫酸亚铁铵晶体的制备与检验
(1)某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都必须煮沸、冷却后再使用,这样处理蒸馏水的目的是_______。向 FeSO4 溶液中加入饱和(NH4)2SO4 溶液,经过操作_______、冷却结晶、过滤、洗涤和干燥后得到一 种浅蓝绿色的晶体。
(2)该小组同学继续设计实验证明所制得晶体的成分。
①如图所示实验的目的是_______,C 装置的作用是_______。
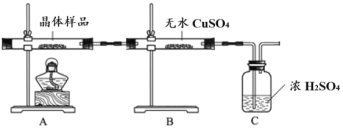
取少量晶体溶于水,得淡绿色待测液。
②取少量待测液,_______ (填操作与现象),证明所制得的晶体中有 Fe2+。
③取少量待测液,经其它实验证明晶体中有NH4+和SO42-
II.实验探究影响溶液中 Fe2+稳定性的因素
(3)配制 0.8 mol/L 的 FeSO4 溶液(pH=4.5)和 0.8 mol/L 的(NH4)2Fe(SO4)2 溶液(pH=4.0),各取 2 ml 上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加 2 滴 0.01mol/L 的 KSCN 溶液,15 分钟后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液;FeSO4溶液则出现淡黄色浑浊。
(资料 1)
沉淀 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 7.6 | 2.7 |
完全沉淀pH | 9.6 | 3.7 |
①请用离子方程式解释 FeSO4 溶液产生淡黄色浑浊的原因_______。
②讨论影响 Fe2+稳定性的因素,小组同学提出以下 3 种假设:
假设 1:其它条件相同时,NH4+的存在使(NH4)2Fe(SO4)2 溶液中 Fe2+稳定性较好。
假设 2:其它条件相同时,在一定 pH 范围内,溶液 pH 越小 Fe2+稳定性越好。
假设 3:_______。
(4)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分 别控制溶液 A(0.2 mol/L NaCl)和溶液 B(0.1mol/L FeSO4)为不同的 pH,
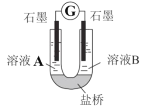
观察记录电流计读数,对假设 2 进行实验研究,实验结果如表所示。
序号 | A:0.2mol·L-1NaCl | B:0.1mol·L-1FeSO4 | 电流计读数 |
实验1 | pH=1 | pH=5 | 8.4 |
实验2 | pH=1 | pH=1 | 6.5 |
实验3 | pH=6 | pH=5 | 7.8 |
实验4 | pH=6 | pH=1 | 5.5 |
(资料 2)原电池装置中,其它条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原 电池的电流越大。
(资料 3)常温下,0.1mol/L pH=1 的 FeSO4 溶液比 pH=5 的 FeSO4 溶液稳定性更好。 根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U 型管中左池的电极反应式____________。
②对比实验 1 和 2(或 3 和 4) ,在一定 pH 范围内,可得出的结论为____________。
③对比实验____________和____________,还可得出在一定pH 范围内溶液酸碱性变化对 O2 氧化性强弱的影响因素。
④ 对(资料 3)实验事实的解释为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于密闭容器中进行的可逆反应:H2(g)+I2(g)![]() 2HI(g),达到化学平衡状态的标志是( )
2HI(g),达到化学平衡状态的标志是( )
A. 正、逆反应速率都等于零 B. H2、I2的浓度相等
C. HI、H2、I2在容器中共存 D. HI、H2、I2的浓度均不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种碳纳米管新型二次电池的装置如图所示。下列说法中正确的是
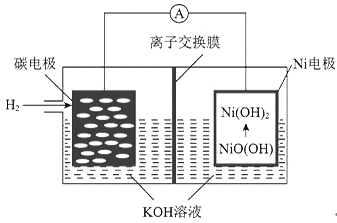
A. 离子交换膜选用阳离子交换膜(只允许阳离子通过) B. 正极的电极反应为NiO(OH)+H2O+e-=Ni(OH)2+OH-
C. 导线中通过1mol电子时,理论上负极区溶液质量增加1g D. 充电时,碳电极与电源的正极相连
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com