
【题目】FeSO4 溶液放置在空气中容易变质,因此为了方便使用 Fe2+,实验室中常保存硫酸亚铁铵晶体[俗称“摩尔盐”,化学式为(NH4)2Fe(SO4)26H2O],它比绿矾或绿矾溶液更稳定。(稳定是指物质放置 在空气中不易发生各种化学反应而变质)
I.硫酸亚铁铵晶体的制备与检验
(1)某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都必须煮沸、冷却后再使用,这样处理蒸馏水的目的是_______。向 FeSO4 溶液中加入饱和(NH4)2SO4 溶液,经过操作_______、冷却结晶、过滤、洗涤和干燥后得到一 种浅蓝绿色的晶体。
(2)该小组同学继续设计实验证明所制得晶体的成分。
①如图所示实验的目的是_______,C 装置的作用是_______。
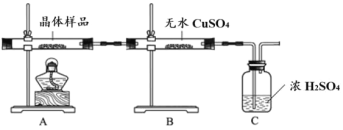
取少量晶体溶于水,得淡绿色待测液。
②取少量待测液,_______ (填操作与现象),证明所制得的晶体中有 Fe2+。
③取少量待测液,经其它实验证明晶体中有NH4+和SO42-
II.实验探究影响溶液中 Fe2+稳定性的因素
(3)配制 0.8 mol/L 的 FeSO4 溶液(pH=4.5)和 0.8 mol/L 的(NH4)2Fe(SO4)2 溶液(pH=4.0),各取 2 ml 上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加 2 滴 0.01mol/L 的 KSCN 溶液,15 分钟后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液;FeSO4溶液则出现淡黄色浑浊。
(资料 1)
沉淀 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 7.6 | 2.7 |
完全沉淀pH | 9.6 | 3.7 |
①请用离子方程式解释 FeSO4 溶液产生淡黄色浑浊的原因_______。
②讨论影响 Fe2+稳定性的因素,小组同学提出以下 3 种假设:
假设 1:其它条件相同时,NH4+的存在使(NH4)2Fe(SO4)2 溶液中 Fe2+稳定性较好。
假设 2:其它条件相同时,在一定 pH 范围内,溶液 pH 越小 Fe2+稳定性越好。
假设 3:_______。
(4)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分 别控制溶液 A(0.2 mol/L NaCl)和溶液 B(0.1mol/L FeSO4)为不同的 pH,

观察记录电流计读数,对假设 2 进行实验研究,实验结果如表所示。
序号 | A:0.2mol·L-1NaCl | B:0.1mol·L-1FeSO4 | 电流计读数 |
实验1 | pH=1 | pH=5 | 8.4 |
实验2 | pH=1 | pH=1 | 6.5 |
实验3 | pH=6 | pH=5 | 7.8 |
实验4 | pH=6 | pH=1 | 5.5 |
(资料 2)原电池装置中,其它条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原 电池的电流越大。
(资料 3)常温下,0.1mol/L pH=1 的 FeSO4 溶液比 pH=5 的 FeSO4 溶液稳定性更好。 根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U 型管中左池的电极反应式____________。
②对比实验 1 和 2(或 3 和 4) ,在一定 pH 范围内,可得出的结论为____________。
③对比实验____________和____________,还可得出在一定pH 范围内溶液酸碱性变化对 O2 氧化性强弱的影响因素。
④ 对(资料 3)实验事实的解释为____________。
【答案】除去水中溶解的氧气,防止氧化Fe2+ 蒸发浓缩 检验晶体中是否含有结晶水 防止空气中水蒸气逆向进入装有无水CuSO4的试管,影响实验结果 滴入少量K3[Fe(CN)6]溶液,出现蓝色沉淀(或先滴入2滴KSCN溶液,无明显变化,再加入几滴新制氯水,溶液变成红色) 4Fe2+ + O2 + 10H2O = 4Fe(OH)3↓ + 8H+ 当其它条件相同时,硫酸根离子浓度大小影响Fe2+的稳定性。(或当其它条件相同时,硫酸根离子浓度越大,Fe2+的稳定性较好。) O2 + 4e- +4H+= 2H2O 溶液酸性越强,Fe2+的还原性越弱 1 3(或2和4) 其它条件相同时,溶液酸性增强对Fe2+的还原性减弱的影响,超过了对O2的氧化性增强的影响。故pH=1的FeSO4溶液更稳定。
【解析】
I.(1)亚铁离子具有还原性,在空气中容易被氧化;向 FeSO4 溶液中加入饱和(NH4)2SO4 溶液,需要经过蒸发浓缩,冷却结晶、过滤、洗涤和干燥后得到一 种浅蓝绿色的晶体;
(2) ①无水硫酸铜遇水变蓝色;空气中也有水蒸气,容易对实验产生干扰;
②检验Fe2+,可以向样品中滴入少量K3[Fe(CN)6]溶液,出现蓝色沉淀,说明存在Fe2+;或先滴入2滴KSCN溶液,无明显变化,再加入几滴新制氯水,溶液变成红色,说明存在Fe2+;
II.(3) ①由表可知,pH=4.5的0.8 mol/L 的 FeSO4 溶液中,会产生Fe(OH)3沉淀,说明二价铁被氧化成了三价铁,同时和水反应生成Fe(OH)3沉淀;
②0.8 mol/L 的 FeSO4 溶液(pH=4.5)和 0.8 mol/L 的(NH4)2Fe(SO4)2 溶液中硫酸根的浓度也不同,可以以此提出假设;
(4) ①FeSO4中的铁的化合价为+2价,具有还原性,在原电池中做负极,则左池的碳电极做正极,NaCl中溶解的氧气得电子生成,在酸性环境中生成水;
②实验1 和 2(或 3 和 4)中NaCl溶液的pH相同,FeSO4溶液的pH不同,且FeSO4溶液的pH越小,电流越小,结合原电池装置中,其它条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原电池的电流越大,可以得出结论;
③对比实验1和3(或2和4)发现,FeSO4溶液的pH相同时,NaCl溶液的pH越大,电流越小,结合原电池装置中,其它条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原电池的电流越大,可以得出结论;
④对比实验1 和 4,NaCl溶液的pH增大酸性减弱,FeSO4溶液的pH减小酸性增强,但是电流却减小,结合②③的结论分析。
I.(1)亚铁离子具有还原性,在空气中容易被氧化,在配制溶液时使用到的蒸馏水都必须煮沸、冷却后再使用,目的是:除去水中溶解的氧气,防止氧化Fe2+;向 FeSO4 溶液中加入饱和(NH4)2SO4 溶液,需要经过蒸发浓缩,冷却结晶、过滤、洗涤和干燥后得到一 种浅蓝绿色的晶体;
(2) ①无水硫酸铜遇水变蓝色,该装置的实验目的是:检验晶体中是否含有结晶水;空气中也有水蒸气,容易对实验产生干扰,需要使用浓硫酸防止空气中水蒸气逆向进入装有无水CuSO4的试管,影响实验结果;
②检验Fe2+,可以向样品中滴入少量K3[Fe(CN)6]溶液,出现蓝色沉淀,说明存在Fe2+;或先滴入2滴KSCN溶液,无明显变化,再加入几滴新制氯水,溶液变成红色,说明存在Fe2+;
II.(3) ①由表可知,pH=4.5的0.8 mol/L 的 FeSO4 溶液中,会产生Fe(OH)3沉淀,说明二价铁被氧化成了三价铁,同时和水反应生成Fe(OH)3沉淀,离子方程式为:4Fe2+ + O2 + 10H2O = 4Fe(OH)3↓ + 8H+;
②0.8 mol/L 的 FeSO4 溶液(pH=4.5)和 0.8 mol/L 的(NH4)2Fe(SO4)2 溶液中硫酸根的浓度也不同,0.8 mol/L 的(NH4)2Fe(SO4)2 溶液中硫酸根浓度更大,故可以假设:当其它条件相同时,硫酸根离子浓度大小影响Fe2+的稳定性;或者当其它条件相同时,硫酸根离子浓度越大,Fe2+的稳定性较好;
(4) ①FeSO4中的铁的化合价为+2价,具有还原性,在原电池中做负极,则左池的碳电极做正极,NaCl中溶解的氧气得电子生成,在酸性环境中生成水,故电极方程式为:O2 + 4e- +4H+= 2H2O;
②实验1 和 2(或 3 和 4)中NaCl溶液的pH相同,FeSO4溶液的pH不同,且FeSO4溶液的pH越小,电流越小,结合原电池装置中,其它条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原电池的电流越大,可以得出的结论是:溶液酸性越强,Fe2+的还原性越弱;
③对比实验1和3(或2和4)发现,FeSO4溶液的pH相同时,NaCl溶液的pH越大,电流越小,结合原电池装置中,其它条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原电池的电流越大,可以得出在一定pH 范围内溶液的碱性越强, O2 氧化性越强;
④对比实验1 和 4,NaCl溶液的pH增大酸性减弱,FeSO4溶液的pH减小酸性增强,但是电流却减小,结合②③的结论,和其它条件相同时,溶液酸性增强对Fe2+的还原性减弱的影响,超过了对O2的氧化性增强的影响。故pH=1的FeSO4溶液更稳定。


科目:高中化学 来源: 题型:
【题目】请同学们根据官能团的不同对下列有机物进行分类。
①CH3CH2OH②![]() ③CH3CH2Br④
③CH3CH2Br④ ![]() ⑤
⑤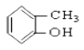 ⑥
⑥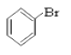 ⑦CH3CHO ⑧
⑦CH3CHO ⑧![]() ⑨
⑨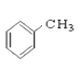 ⑩
⑩ 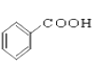
(1)芳香烃:______________;
(2)卤代烃:_______________;
(3)醇:______________;
(4)酚:______________;
(5)醛:______________ ;
(6)酯:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10 mL0.1 mol/L的HR溶液中逐滴加入0.1 mol/L的氨水,所得溶液pH及导电能力变化如图。下列分析正确的是( )
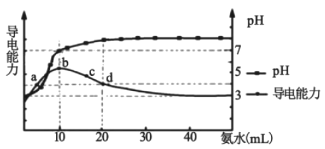
A. 各点溶液中的阳离子浓度总和大小关系:d>c>b>a
B. 常温下,R- 的水解平衡常数数量级为10 -9
C. a点和d点溶液中,水的电离程度相等
D. d点的溶液中,微粒浓度关系:c(R-)+2c(HR)=c(NH3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际能源期刊报道了一种正在开发中的绿色环保“全氢电池”,有望减少废旧电池产生的污染。其工作原理如图所示。下列说法正确的是
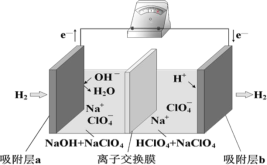
A.“全氢电池”工作时,将酸碱反应的中和能转化为电能
B.吸附层 b 发生的电极反应:H2 – 2 e+ 2OH= 2H2O
C.NaClO4 的作用是传导离子和参与电极反应
D.“全氢电池”的总反应: 2H2 + O2 =2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水垢中含有的 CaSO4,可先用 Na2CO3 溶液处理,使之转化为疏松、易溶于酸的 CaCO3。某化学兴趣小组用某浓度的 Na2CO3 溶液处理一定量的 CaSO4 固体,测得所加 Na2CO3 溶液体积与溶液中-lgc(CO32-)的关系如下:
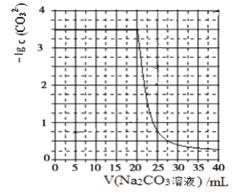
已知Ksp(CaSO4)=9×10-6,Ksp(CaCO3)=3×10-9,lg3=0.5,下列说法不正确的是
A.曲线上各点的溶液满足关系式![]()
B.CaSO4(s)+ ![]() (aq)
(aq)![]() CaCO3(s)+
CaCO3(s)+![]() (aq)K=3×103
(aq)K=3×103
C.该Na2CO3溶液的浓度为1.5 mol/L
D.相同实验条件下,若将Na2CO3溶液的浓度改为原浓度的2倍,则上图曲线整体向上平移1个单位即可
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定
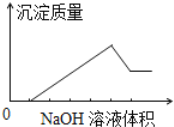
(1)原溶液中含有的阳离子是(_____)
A.Mg2+、Al3+、Fe2+ B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+ D.只有Mg2+、Al3+
(2)若原溶液的体积为100mL,生成沉淀的最大质量为10.7g,最终生成沉淀的质量为2.9g,则原溶液中Al3+的物质的量浓度为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配置100ml1mol/L的Na2CO3溶液,填空并回答问题:
(1)配置100ml 1mol/L 的Na2CO3溶液。用托盘天平称量碳酸钠的质量为___________
(2)将上述溶液全部倒入500mL烧杯中,逐滴加入1mol/L的盐酸,开始无气泡产生,原因是_____(用化学方程式表示)
(3)当加入盐酸______mL时开始产生气体,最后共产生气体在标准状况下的体积是______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,氧杂螺戊烷的结构简式为![]() ,则下列说法正确的是
,则下列说法正确的是
A. lmol该有机物完全燃烧需要消耗5.5molO2
B. 二氯代物超过3种
C. 该有机物与环氧乙烷互为同系物
D. 该有机物所有碳、氧原子处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌猛干电池是日常生活中常用的一次电池。一种处理废旧干电池的流程如下:

下列叙述错误的是
A. 合理处理废旧电池有利于保护环境和资源再利用
B. “水浸”后的滤渣干燥后经充分灼烧可回收其中的MnO2
C. “沉淀”反应后的滤液可通过蒸发至干回收NH4Cl
D. “沉淀”反应的离子方程式为:Zn2+ + 2NH3·H2O = Zn(OH)2↓ + 2NH4+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com