
【题目】对于以下反应:A(s)+3B(g)![]() 2C(g)+D(g),在一定温度、压强下,在一体积可变的容器中,当下列物理量不再发生变化时就可确定反应一定达到平衡状态的是
2C(g)+D(g),在一定温度、压强下,在一体积可变的容器中,当下列物理量不再发生变化时就可确定反应一定达到平衡状态的是
A.容器的体积不再发生变化
B.B的生成速率和D的反应速率之比为3∶1
C.混合气体的密度不随时间变化
D.B、C、D的分子个数之比为3∶2∶1
科目:高中化学 来源: 题型:
【题目】已知硫酸钠晶体(![]() )的物质的量为1.5mol,请计算填空:
)的物质的量为1.5mol,请计算填空:
(1)所含钠离子的物质的量是________,钠离子的数目是________。
(2)所含硫酸根离子的物质的量是________,所含氧原子的数目是________。
(3)硫酸钠晶体(![]() )是_______________________(填“纯净物”或“混合物”)
)是_______________________(填“纯净物”或“混合物”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴元素由于其良好的物理化学性质,被广泛应用于生产生活中。从含钴废料(含CoO、Co2O3、单质Al、Li等)中制取粗CoCl2·6H2O的流程如下所示。
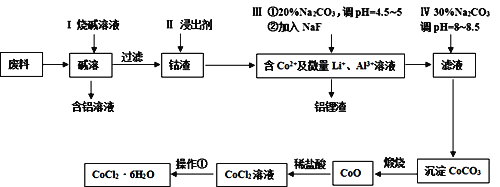
请回答下列问题:
(1)步骤I中主要发生的化学反应方程式为______。
(2)已知Co2O3具有强氧化性,若步骤II中浸出剂为盐酸,造成的后果是_______。
(3)步骤Ⅲ中①的目的是除去Al3+,写出该步反应的离子方程式______。
(4)若在实验室煅烧CoCO3,所需的硅酸盐质仪器除酒精灯和玻璃棒外,还有______、______(填仪器名称)。
(5)操作①是在HCl氛围中进行的,其步骤是______、_____、过滤、洗涤、干燥。洗涤过程中可以用工业酒精代替水,其优点是_____。
(6)某同学用标准硝酸银溶液滴定未知浓度的CoCl2溶液,下列可作为指示剂的是____(填选项,忽略亚钴离子的颜色干扰)
A.KCl B.KSCN C.K2CrO4 D.K2S
已知几种物质在20℃时的颜色及Ksp值如下表
化学式 | AgCl | AgSCN | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黑色 | 红色 |
Ksp | 2.0×10-10 | 1.0×10-12 | 2.0×10-48 | 2.0×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:
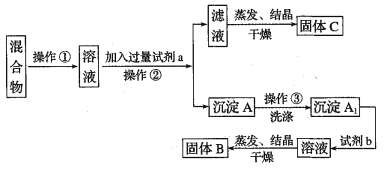
供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作②的名称是______________,试剂a的溶质是_______________(填化学式)。
(2)加入试剂b所发生反应的化学方程式为_____________________________。
(3)该方案有不足之处,请你把它找出来并改进:_______________________________。
(4)操作③为什么要洗涤沉淀A:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各选项对应关系错误的是
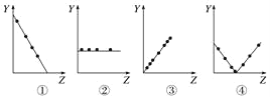
A.图①可以表示F-、Na+、Mg2+、Al3+四种半径的大小关系
B.图②可以表示ⅡA族元素原子的最外层电子数
C.图③可以表示第三周期各主族元素的最高化合价
D.图④可以表示第三周期中各主族元素的最高化合价与最低化合价之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C三种烃的球棍模型如图所示:
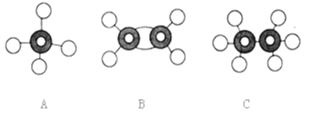
(1)A、B、C的分子式分别是________、________、________;
(2)在120℃、1.01×105Pa时,有两种气态烃和足量的氧气混合点燃,相同条件下测反应前后气体体积,没有发生变化,这两种气态烃是________;
(3)写出B转化为C的化学方程式:_________________________________________________;
(4)除去气体C中混有的少量B可选用的试剂名称是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰硫酸(NOSO4H)纯品为棱形结晶,溶于硫酸,遇水易分解,常用于制染料。SO2和浓硝酸在浓硫酸存在时可制备NOSO4H,反应原理为:SO2 + HNO3 = SO3 + HNO2、SO3 + HNO2 = NOSO4H。
(1)亚硝酰硫酸(NOSO4H)的制备。
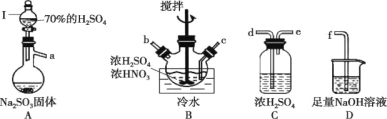
①仪器I的名称为______________,打开其旋塞后发现液体不下滴,可能的原因是_________________。
②按气流从左到右的顺序,上述仪器的连接顺序为__________________(填仪器接口字母,部分仪器可重复使用)。
③A中反应的方程式为___________。
④B中“冷水”的温度一般控制在20℃,温度不宜过高或过低的原因为________。
(2)亚硝酰硫酸(NOSO4H)纯度的测定。
称取1.500 g产品放入250 mL的碘量瓶中,并加入100.00 mL浓度为0.1000 mol·L-1的KMnO4标准溶液和10 mL 25%的H2SO4,摇匀;用0.5000 mol·L-1的Na2C2O4标准溶液滴定,滴定前读数1.02 mL, 到达滴定终点时读数为31.02 mL。
已知:i:□KMnO4 + □NOSO4H + □______ = □K2SO4 + □MnSO4 + □HNO3 + □H2SO4
ii:2KMnO4 + 5Na2C2O4 + 8H2SO4 = 2MnSO4 +10CO2↑+ 8H2O
①完成反应i的化学方程式:_____________
□KMnO4 + □NOSO4H + □______ = □K2SO4 + □MnSO4 + □HNO3 + □H2SO4
②滴定终点的现象为____________________。
③产品的纯度为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124 g P4中所含P—P键数目为4NA
B. 100 mL 1mol·L1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的原子结构如下表:
元素 编号 | 元素原子结构 |
X | 原子结构示意图为 |
Y | 最外层电子数是次外层电子数的2倍 |
Z | 原子核内含有12个中子,且其离子的结构示意图为 |
(1)写出X的元素名称:________,元素Y的最简单氢化物的结构式为___________;
(2)Z元素原子的质量数为________;
(3)X和Z两种元素的简单离子,离子半径大的是________(填离子符号),X和Z两种元素的最高价氧化物对应的水化物相互反应的离子方程式为_____________;
(4)Y和Z两种元素的最高价氧化物发生氧化还原反应的化学方程式为_________________,若反应过程中转移电子数为6.02×1023,则消耗Y的最高价氧化物的质量为__________;
(5)写出Z2O2的电子式______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com