
【题目】(1)12.4g Na2X含有0.4mol Na+,Na2X的摩尔质量为_____,X的相对原子质量为_____。
(2)相同状况下,一定体积的气态氢化物H2X的质量是等体积NH3的2倍.则X的相对原子质量为_____。
(3)0.05mol 的硫酸钠中含有_____个氧原子;与_____g NaCl中所含有的Na+数目相同.
(4)气态化合物A的化学式可以表示为OxFy,已知同温同压下10mLA受热完全分解生成15mLO2和10mL F2,则A的化学式为_____。
(5)0.5L 0.5mol/L FeCl3溶液中的Cl﹣的物质的量浓度为_____。
(6)质量分数为98%,密度为1.84g.cm﹣3的某浓硫酸,溶质的物质的量浓度为_____。
(7)a个X原子的总质量为b g,则X的相对原子质量可表示为_____。
【答案】62g/mol 16 32 0.2NA 5.85 O3F2 1.5mol/L 18.4mol/L b/aNA
【解析】
(1)根据![]() 计算Na2X的摩尔质量;摩尔质量的数值等于相对分子质量。
计算Na2X的摩尔质量;摩尔质量的数值等于相对分子质量。
(2)相同状况下,同体积的气体,质量比等于摩尔质量之比;
(3)氧原子的物质的量为硫酸钠的4倍,根据N=nNA计算氧原子数目;根据钠离子守恒计算氯化钠的物质的量,再根据m=nM计算氯化钠的质量。
(4)根据原子守恒计算OxFy的化学式;
(5)由化学式可知,Cl-的物质的量浓度为FeCl3浓度3倍;
(6)根据![]() 计算;
计算;
(7)根据![]() 计算;
计算;
(1) 含有0.4mol Na+的Na2X 的物质的量是0.2mol, Na2X的摩尔质量是![]() 62g/mol , X的相对原子质量为62-23×2=16。
62g/mol , X的相对原子质量为62-23×2=16。
(2)相同状况下,同体积的气体,质量比等于摩尔质量之比,![]() ,M(H2X)=34 g/mol,则X的相对原子质量为34-1×2=32。
,M(H2X)=34 g/mol,则X的相对原子质量为34-1×2=32。
(3)氧原子的物质的量为硫酸钠的4倍,n(O)=4n(Na2SO4)=0.05mol×4=0.2mol,故N(O)=0.2mol×NA=0.2NA;钠离子的物质的量是硫酸钠的2倍,n(Na+)=2n(Na2SO4)=0.05mol×2=0.1mol,故含有相同钠离子的NaCl的质量为:0.1mol×58.5g/mol=5.85g;
(4)根据原子守恒
2OxFy=xO2+yF2
2 x y
10 15 10
![]()
X=3,y=2
OxFy的化学式是O3F2;
(5)由化学式可知,Cl-的物质的量浓度为FeCl3浓度3倍,故0.5mol/LFeCl3溶液中的Cl-的物质的量浓度为0.5mol/L×3=1.5mol/L;
(6)根据![]() ,质量分数为98%,密度为1.84g.cm﹣3的某浓硫酸,
,质量分数为98%,密度为1.84g.cm﹣3的某浓硫酸,![]() 18.4mol/L;
18.4mol/L;
(7) ![]() ,a个X原子的总质量为b g ,则
,a个X原子的总质量为b g ,则![]() ,所以M= b/aNA。
,所以M= b/aNA。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】海水提镁的主要流程如下,下列说法正确的是

①试剂M是盐酸 ②流程中的反应全部都是非氧化还原反应
③操作b只是过滤 ④用海水晒盐后的饱和溶液加石灰乳制Mg(OH)2
⑤采用电解法冶炼镁是因为镁很活泼
A. ①②③④⑤ B. ②③ C. ④⑤ D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明代《本草纲目》收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和精人甑,蒸令气上……其清如水,球极浓烈,盖酒露也。”这里所用的“法”是指
A. 萃取 B. 过滤 C. 蒸馏 D. 升华
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Cl2、NaOH、CO(NH2)2 (尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:

已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。

(1)如图表示用石墨作电极,在一定条件下电解饱和食盐水制取Cl2时,阳极上产生也会产生少量的ClO2的电极反应式:________________________________;电解一段时间,当阴极产生标准状况下气体112 mL时,停止电解,则通过阳离子交换膜的阳离子物质的量为________mol。
(2)步骤Ⅰ制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
(3)步骤Ⅱ合成N2H4·H2O的装置如下图所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_________________;使用冷凝管的目的是_________________________________。
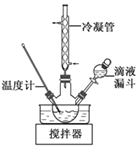
(4)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3,欲测定亚硫酸钠产品的纯度设计如下实验方案,并进行实验。准确称取所得亚硫酸钠样品m g于烧杯中,加入适量蒸馏水配成100 mL待测溶液。移取25.00 mL待测溶液于锥形瓶中,用c mol·L-1酸性KMnO4标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(假设杂质不反应)。样品中亚硫酸钠的质量分数为__________(用含m、c、V的代数式表示)。某同学设计的下列滴定方式中,合理的是________(夹持部分略去)(填字母序号)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在同温同压下,相等质量的氧气和臭氧,它们的物质的量之比为_____,分子个数比为_____,原子个数比为_____。
(2)在一密闭容器中充入a mol NO 和b mol O2,可发生如下反应:2NO+O2═2NO2,充分反应后容器中氮原子和氧原子的个数之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知299 K时,合成氨反应N2(g ) + 3H2 ( g )![]() 2NH3( g ) △H =" -92.0" kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
2NH3( g ) △H =" -92.0" kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
A. 一定大于92.0 kJ B. 一定等于92.0 kJ
C. 一定小于92.0 kJ D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652 kJ的热量。
(1)此反应的热化学方程式为________________。
(2)又已知H2O(g)===H2O(l) ΔH=-44 kJ·mol-1则16 g液态肼与足量液态双氧水反应生成液态水时放出的热量为________kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是_______________。
(4)发射卫星可用气态肼(N2H4)作燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:
N2(g)+2O2(g)===2NO2(g) ΔH=+67.7 kJ·mol-1 ①
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1 ②
气态肼和二氧化氮反应的热化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述与胶体知识无关的是
A. 向氯化铁溶液中加入过量氢氧化钠溶液会看到红褐色沉淀
B. 江河入海口常有三角洲形成
C. 在电影院看电影,会看到从放映室到银幕的光柱
D. “卤水点豆腐”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案能达到相应实验目的的是
选项 | 实验目的 | 实验方案 |
A | 分离Fe2O3、Al2O3 | 将混合物投入足量NaOH溶液中然后依次进行过滤、洗涤、蒸发、灼烧四项操作 |
B | 验证淀粉溶液水解生成葡萄糖 | 向淀粉溶液中加入稀硫酸共热,冷却后再加入新制Cu(OH)2悬浊液,加热 |
C | 制备无水AlCl3 | 蒸发铝与稀盐酸反应后的溶液 |
D | 检验FeCl2晶体是否完全变质 | 取少量久置的FeCl2晶体于试管中,逐滴加入酸性高锰酸钾溶液 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com