
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间的转化关系如图所示。已知:淀粉遇单质碘变蓝。下列说法中,不正确的是( )
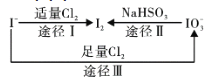
A.氧化性的强弱顺序为:Cl2>IO3->I2
B.途径Ⅱ中若生成1mol I2,消耗4mol NaHSO3
C.一定条件下,I-与IO3-反应可能生成I2
D.向含I-的溶液中通入Cl2,所得溶液加入淀粉溶液不一定变为蓝色
【答案】B
【解析】
由题给信息可知,途径Ⅰ反应的离子方程式为2I—+Cl2=2Cl—+I2,途径Ⅱ反应的离子方程式为2IO3-+ 5HSO3—=I2+5SO42—+3H++H2O,途径Ⅲ反应的化学方程式为5Cl2+I2+6H2O═2HIO3+10HCl。
A项、由途径I可知氧化性Cl2>I2,由途径Ⅱ可知氧化性I2<IO3-,由途径Ⅲ可知氧化性Cl2>IO3-,故氧化性的强弱顺序为Cl2>IO3->I2,故A正确;
B项、由途径Ⅱ反应的离子方程式可知,生成1molI2,反应消耗5molNaHSO3,故B错误;
C项、由氧化性I2<IO3-可知,一定条件下,I-与IO3-反应可能生成I2,故C正确;
D项、根据图中转化关系可知Cl2可以把I-氧化成IO3-,则向含I-的溶液中通入过量Cl2,所得溶液加入淀粉溶液不变蓝色,故D正确;
故选B。


科目:高中化学 来源: 题型:
【题目】某课外活动小组收集了一种合金进行以下探究(已知铜元素的焰色反应呈绿色)。
(1)外观暗灰色,表皮光滑;
(2)在酒精灯外焰上灼烧,火焰呈绿色,合金片熔化,但不滴落;
(3)取刮去表皮的合金10 g,放入足量的稀硫酸中,收集到标准状况下的H2 8.96 L;
(4)另取刮去表皮的合金10 g,放入足量的NaOH溶液中,也收集到标准状况下的H2 8.96 L。
试据此判断,该合金中一定含有的元素是________(写元素符号);可能含有的元素是________(填选项编号)。
a.Ag b.Mg
c.Na d.Fe
如果该合金中只含2种元素,则二者的质量比是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用 0.100 mol /L 盐酸滴定 20.00 mL 0.100 mol/L的CH3COONH4溶液,滴定曲线如下图所示,下列说法正确的是( )

A.可用酚酞作滴定指示剂
B.滴定过程中水的电离程度不断增大
C.P点溶液中:2c(![]() )<3c(CH3COO-)+c(CH3COOH)
)<3c(CH3COO-)+c(CH3COOH)
D.Q点溶液中:c(Cl-)>c(![]() )>c(CH3COO-)>c(H+)
)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在①蛋白质 ②油脂 ③葡萄糖 ④纤维素⑤淀粉五种物质中,不能水解的是______(填序号),在人体中不能直接被消化吸收的是________(填序号),蛋白质水解后最终生成__________(填名称),油脂水解后得到醇的结构简式是_________。
(2)某学生设计用如下实验方案用以检验淀粉水解的情况:

由水解液分别进行上述实验后的现象,可得出的实验结论应该是________(填序号)。
A.淀粉尚有部分未水解
B.淀粉已完全水解
C.淀粉没有水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探索工业含铝、铁、铜合金废料的再利用,某同学设计的回收利用方案如下:
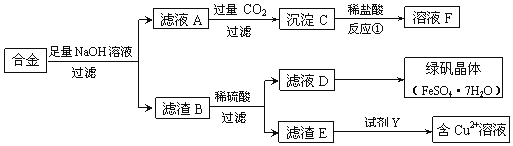
(1)合金与足量氢氧化钠溶液反应的离子方程式是______。
(2)若D中含有Fe3+,除去Fe3+的常用试剂是______。
(3)若要从滤液D中得到绿矾晶体,必须进行的实验操作步骤:______、______、过滤、洗涤、自然干燥。
(4)若由滤渣E得到含Cu2+的溶液,试剂Y选用稀硝酸,则化学方程式为:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合金由选项中的两种或两种以上金属组成,为测定其组成,取10克该金属投入到足量的盐酸中充分反应后,生成的氢气在标准状况下体积为11.2L,则混合物中一定含有的金属是
A.锌B.铁C.铝D.镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ba(AlO)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述正确的是

A.a—b时沉淀的物质的量:Al(OH)3比BaSO4多
B.c—d时溶液中离子的物质的量:AlO2-比Ba2+多
C.a—d时沉淀的物质的量:BaSO4可能小于Al(OH)3
D.d—e溶液中离子的物质的量:Ba2+不可能等于OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用的几种气体发生装置如图A、B、C所示:

(1)实验室可以用B或C装置制取氨气,如果用C装置,通常使用的药品是_______;
(2)气体的性质是选择气体收集方法的主要依据。下列性质与收集方法无关的是______(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
如图是某学生设计收集气体的几种装置,其中不可行的是________。

(3)若用A装置与D装置相连制取收集X气体,则X可能是下列气体中的_______。
①CO2 ②NO ③Cl2 ④H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A、B、C、D、E的原子序数依次增大,且均小于36。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;D的价电子数为2且与E同周期;E的基态原子的内部各能层均排满,且4s能级有1个单电子。回答下列问题:
(1)基态E原子的价电子排布式为____________________
(2)A、B、C三种元素第一电离能由大到小的顺序为___________(用元素符号表示)。
(3)与A的单质分子互为等电子体的分子和离子分别是________(用分子和离子符号表示)。AB2的空间构型为___________,其中A原子的杂化类型是_______________
(4)B元素简单氢化物的沸点是同族元素中最高的,原因是_____________
(5)向含E元素的硫酸盐溶液中加入过量氨水,可得到深蓝色透明溶液。向溶液中加人乙醇,将析出深蓝色晶体。该晶体的化学式为[Cu(NH3)4]SO4H2O晶体中阳离子的结构式为____________
(6)C和D形成化合物的晶胞结构如图所示,已知晶体的密度为ρg/cm,阿伏加德罗常数为NA,则晶胞边长a=______________cm(用含ρ、NA的计算式表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com