
25℃时,在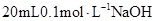 溶液中逐滴加入
溶液中逐滴加入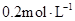 醋酸溶液,pH的变
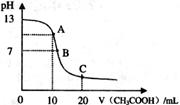
醋酸溶液,pH的变 化曲线如右图所示,有关粒子浓度关系的比较中,不正确的是
化曲线如右图所示,有关粒子浓度关系的比较中,不正确的是
 A.在A点:
A.在A点: 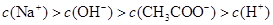
 B.在B点:
B.在B点: 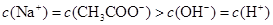
 C.在C点:
C.在C点: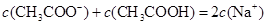
 D.在C点:
D.在C点: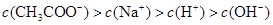
A
【解析】
试题分析:根据溶液的体积可知,A点二者恰好中和,溶质是醋酸钠,水解显碱性,A不正确,应该是c(Na+)>c(CH3COO-)>c(OH-) >c(H+); B点溶液显中性,正确;C点溶质是醋酸钠和醋酸,且二者的物质的量相等,根据物料守恒可知,C正确;C点溶液显酸性,D正确,答案选A。
考点:考查酸碱中和滴定中溶液酸碱性的判断以及离子浓度大小比较等
点评:判断酸碱中和后溶液的酸碱性时,应该首先判断酸或碱的过量问题,只有当二者恰好反应时才能考虑生成的盐是否水解。另外比较溶液中离子浓度大小比较时,应该遵循几个守恒关系式,即电荷守恒定律、物料守恒和质子守恒。


科目:高中化学 来源:2012-2013学年江西省南昌二中高二第二次月考化学试卷(带解析) 题型:单选题
25℃时,在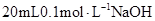 溶液
溶液 中逐滴加入
中逐滴加入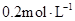 醋酸溶液,pH的变
醋酸溶液,pH的变 化曲线如右图所示,有关粒子浓度关系的比
化曲线如右图所示,有关粒子浓度关系的比 较中,不正确的是
较中,不正确的是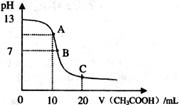
查看答案和解析>>
科目:高中化学 来源:2010年河北正定中学高三年级第四次考试 题型:选择题
25℃时,下列溶液中微粒的物质的量浓度关系正确的是

A. 的
的 与
与 混合溶液中:
混合溶液中: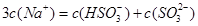
B.0.1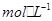 的KHA溶液,其PH=10 c(K+)﹥c(OH-)﹥c(HA-)
的KHA溶液,其PH=10 c(K+)﹥c(OH-)﹥c(HA-)
C.20mL
0.1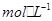 醋酸钠溶液与10mL 0.1
醋酸钠溶液与10mL 0.1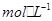 盐酸混合后的溶液中:
盐酸混合后的溶液中:
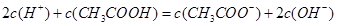
D.在25mL
0.1 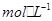
 溶液中逐滴加入0.2
溶液中逐滴加入0.2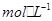
 溶液,溶液pH变化如右图所示,在A、B间任一点,溶液中一定都存在下列关系:
溶液,溶液pH变化如右图所示,在A、B间任一点,溶液中一定都存在下列关系:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com