
[Ⅰ] 硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验由废铁屑(含Fe2O3)制备FeSO4·7H2O晶体过程如下: (铁屑先用Na2CO3溶液洗涤去除了油污)
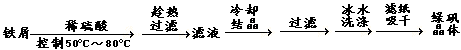
(1)铁屑溶解时发生主要反应的离子方程式____________________________
(2)有关制备中的分析错误的是_______
①铁屑需过量放可除去产生的Fe3+且利于防止产生Fe3+;②趁热过滤目的是加快过滤速度;③硫酸过稀致使溶液浓度过低不利于晶体大量析出;④冰水洗涤能减少晶体的溶解损失;⑤控制温度50)C~80)C利于制成饱和溶液,加速铁屑的溶解;
(3)检验滤液中是否含有的Fe3+方法是_____________________________________
 [Ⅱ]硫酸最古老工业生产方法是“铅室法”:以绿矾为原料,在铅制蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O
[Ⅱ]硫酸最古老工业生产方法是“铅室法”:以绿矾为原料,在铅制蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O![]() Fe2O3+SO3↑+SO2↑+14H2O↑。抽出混合气体冷凝便得到浓硫酸。
Fe2O3+SO3↑+SO2↑+14H2O↑。抽出混合气体冷凝便得到浓硫酸。
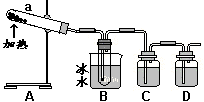
用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和SO2。
(4)① 试管b中得到的主要产物是___________,
② 为检验SO2生成物,试管c中应加入的试剂
是__________
③ B中所得硫酸的理论浓度(溶质的质量分数)为_________
(5)这一古老的制备方法被淘汰,除原料有限和能耗较高还可能原因有____________
 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 滴定次数 实验数据 |
1 | 2 | 3 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 |
| V(KMnO4)/mL(初读数) | 0.00 | 0.20 | 0.00 |
| V(KMnO4)/mL(终读数) | 15.85 | 15.22 | 14.98 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
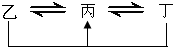 元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题:
元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学实验的操作或说法正确的是 (填字母序号)
A.中和热测定实验中,温度计测完盐酸的温度直接插入氢氧化钠溶液测温度
B.检验红砖中的氧化铁成分时,向红砖粉末中加入盐酸,放置至充分沉淀后,取上层清液于试管中,滴加KSCN溶液2~3滴即可
C.苯酚和医用酒精均能杀菌消毒,因为它们都可使蛋白质变性
D.在进行硫酸铜晶体里结晶水含量的测定实验中,称量操作至少要进行4次
E.制备硫酸亚铁晶体时,向稀硫酸中加入废铁屑至有少量气泡发生时,过滤,然后加热蒸干滤液即可得硫酸亚铁晶体
F.糖尿病人的尿液中含有葡萄糖,可以用新制氢氧化铜悬浊液检验
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com