
【题目】前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,平且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2,并在同一族。
回答下列问题:
(1)D2+的价层电子排布图为_______。
(2)四种元素中第一电离最小的是______,电负性最大的是_______。(填元素符号)
(3)A、B和D三种元素组成的一个化合物的晶胞如图所示。

①该化合物的化学式为_________;
②列式计算该晶体的密度_____g·cm-3(列式即可,不必计算)。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,期中化学键的类型有_____;该化合物中存在一个复杂离子,该离子的化学式为_______,配位体是____。
【答案】![]() K F K2NiF4
K F K2NiF4 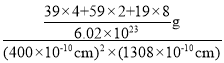 离子键、配位键 [FeF6]3- F-
离子键、配位键 [FeF6]3- F-
【解析】
前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有一个,并且A-和B+的电子数相差为8,A属于第VIIA族元素,B属于第IA族元素,且A的原子序数小于B,则A是F元素,B是K元素;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2,且C和D的原子序数大于B,C的原子序数小于D,则C是Fe元素,D是Ni元素.
由分析可知:A是F,B是K,C是Fe,D是Ni;
(1)Ni2+的价层电子为3d电子,根据能量最低原理、保里不相容原理及洪特规则知,其价电子排布图为![]() ,故答案为:
,故答案为:![]() ;
;
(2)元素的金属性越强其第一电离能越小,元素的非金属性越强,其电负性越大,这四种元素中金属性最强的是K元素,非金属性最强的元素是F,所以第一电离能最小的是K,电负性最大的是F,故答案为:K;F;
(3)①该晶胞中F原子个数![]() ,K原子个数
,K原子个数![]() ,Ni原子个数
,Ni原子个数![]() ,所以该化合物的化学式为K2NiF4,故答案为:K2NiF4;
,所以该化合物的化学式为K2NiF4,故答案为:K2NiF4;
②该晶胞的体积![]() ,晶胞质量
,晶胞质量![]() ,故晶体密度
,故晶体密度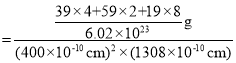 ,故答案为
,故答案为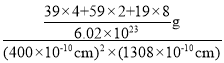 :;
:;
(4)F-、K+和Fe3+三种离子组成的化合物K3FeF6,Fe3+含有空轨道,为中心离子,F-含有孤对电子,为配体,二者之间形成配位键,形成配离子[FeF6]3-,[FeF6]3-与K+之间形成离子键,故答案为:离子键、配位键;[FeF6]3-;F-。


科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是
A.0.1mol·L-1NaOH溶液:Na+、K+、![]() 、
、![]()
B.0.1mol·L-1Fe2(SO4)3溶液:Cu2+、![]() 、SCN-、
、SCN-、![]()
C.0.1mol·L-1Na2S溶液:Na+、K+、ClO-、OH-
D.0.1mol·L-1NH4HCO3溶液:Ba2+、K+、OH-、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铅蓄电池为电源.将CO2转化为乙烯的装置如图所示,电解所用电极材料均为惰性电极。下列说法不正确的是( )
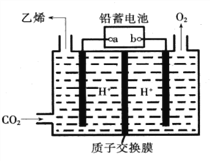
A. b为铅蓄电池的正极
B. 每生成1mol乙烯,理论上铅蓄电池中消耗12mol硫酸
C. 电解过程中,阳极区溶液中c(H+)逐渐减小
D. 阴极反应式:2CO2+12H++12e-=C2H4+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国西昌卫星发射中心用“长征三号丙”运载火箭成功发射嫦娥二号探月卫星,火箭的燃料之一是铝粉与高氯酸铵(NH4ClO4)的固体混合物,点燃时,铝粉被氧化放热引发高氯酸铵反应:2NH4ClO4=N2↑+4H2O+Cl2↑+2O2↑,反应放出大量的热。
(1)该反应中被氧化的元素是_____________。
(2)对该反应的反应类型判断正确的是_____________。
A.氧化还原反应B.复分解反应C.置换反应D.分解反应
(3)该反应中若生成1moLCl2,则电子转移数为_____________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁二酮肟镍是丁二酮肟在氨性溶液(pH=8~9)中与Ni2+发生反应生成的沉淀,该反应常用作实验室中检验镍离子。其结构如图所示,下列对该物质的分析与判断中,正确的是

A.该物质中Ni原子具有空轨道,是配合物的配体
B.该物质中C、N、O原子存在孤电子对
C.该物质的分子中含有的化学键有共价键和配位键
D.该物质中碳原子的杂化类型均为sp2杂化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com