
【题目】下列离子组一定能大量共存的是
A.能使pH试纸显红色的溶液中:Na+、NH4+、I-、NO3-
B.含有0.1mol/L Fe3+的溶液中:K+、Mg2+、S2-、SO32-
C.由水电离出来的c(H+)=1×10-13mol/L的溶液中:K+、CO32-、Cl-、NO3-
D.常温下,![]() 的溶液:Na+、K+、CO32-、NO3-
的溶液:Na+、K+、CO32-、NO3-
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】实验室通常用氧化剂+浓盐酸![]() 金属氯化物+水+氯气的原理制取少量Cl2。现将一定质量的NaClO放入100 mL 10.00 mol·L-1的浓盐酸中,生成的Cl2在标准状况下的体积为1.12 L。试计算(反应前后溶液的体积变化忽略不计):
金属氯化物+水+氯气的原理制取少量Cl2。现将一定质量的NaClO放入100 mL 10.00 mol·L-1的浓盐酸中,生成的Cl2在标准状况下的体积为1.12 L。试计算(反应前后溶液的体积变化忽略不计):
(1)反应过程中,被氧化的HCl的物质的量为____mol。
(2)反应后溶液中HCl的物质的量浓度为____mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:

已知NaHCO3在低温下溶解度较小。
反应Ⅰ:NaCl+CO2+NH3+H2O![]() NaHCO3↓+NH4Cl,处理母液的两种方法:
NaHCO3↓+NH4Cl,处理母液的两种方法:
(1)向母液中加入石灰乳,可将其中________循环利用。
(2)向母液中通入NH3,加入细小的食盐颗粒并降温,可得到NH4Cl晶体。试写出通入NH3后,溶解度较小的酸式碳酸盐转变为溶解度较大的碳酸盐的离子方程式 ___________。
Ⅱ.某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下图所示装置制取NaHCO3,然后再将NaHCO3制成Na2CO3。
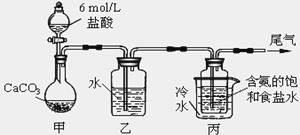
(1)装置丙中冷水的作用是_________;
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有_______、洗涤、灼烧。NaHCO3转化为Na2CO3的化学方程式为______;
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1 min的NaHCO3 样品的组成进行了以下探究。
取加热了t1 min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如图所示。
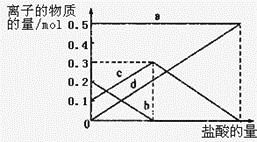
则曲线a对应的溶液中的离子是___________(填离子符号下同);曲线c对应的溶液中的离子是___________;该样品中NaHCO3和Na2CO3的物质的量之比是___________; 21
(4)若取21.0 g NaHCO3固体,加热了t2rnin后,剩余固体的质量为l4.8 g。如果把此剩余固体全部加入到200 mL 2 molL—1的盐酸中,则充分反应后溶液中H+ 的物质的量浓度为____________(设溶液体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳的单质及其化合物是常见的物质。完成下列填空:
已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:C(石墨)+O2(g)→CO2(g)+393.51kJ;C(金刚石)+O2(g)→CO2(g)+395.41kJ
(1)等质量时石墨的能量比金刚石的___(选填“高”或“低”),由石墨制备金刚石是___反应(选填“吸热”或“放热”)。
由焦炭与石英在高温的氮气流中反应,可制得一种新型陶瓷材料——氮化硅(Si3N4):C+SiO2+N2→Si3N4+CO(未配平)
(2)配平后的化学方程式各物质的化学计量数依次是___。若已知CO生成速率为v(CO)=12mol/(L·min),则N2消耗速率为v(N2)=___mol/(L·min)。
一定温度下10L密闭容器中发生某可逆反应,其平衡常数表达式为:K=![]() 。
。
(3)该反应的化学方程式为___。
(4)能判断该反应一定达到平衡状态的是___。
a.v正(H2O)=v逆(CO)
b.容器中气体的相对分子质量不随时间改变
c.消耗nmolH2同时消耗nmolCO
d.容器中物质的总物质的量不随时间改变
(5)已知常温下0.1mol/L碳酸氢钠溶液的pH=8.4,该溶液中的c(H2CO3)___c(CO32-)(选填“>”、“=”或“<”);该溶液电中性的表达式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: X(g)+2Y(g) ![]() 3Z(g) ΔH=-a kJ·molˉ1(a>0)。下列说法正确的是
3Z(g) ΔH=-a kJ·molˉ1(a>0)。下列说法正确的是
A. 达到化学平衡状态时,Y 的正反应速率和 Z 的逆反应速率相等
B. 达到化学平衡状态时,X、Y、Z 的浓度之比为 1 : 2 : 3
C. 达到化学平衡状态时,反应放出的总热量一定小于 a kJ
D. 0.2 mol X 和 0.2 mol Y 充分反应生成 Z 的物质的量一定小于 0.3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100mol/L NaOH溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸。下列说法正确的是
A.起始时盐酸和醋酸溶液的pH相同
B.V(NaOH)=10.00mL时,醋酸溶液中,![]()
C.恰好中和时,两种酸所用NaOH溶液体积不相等,醋酸用的体积少
D.V(NaOH)=20.00mL时,c(Cl-)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有3.2g某气体(分子式:RH4),摩尔质量为16 g·mol-1,则:
(1)R的相对原子质量为____________
(2)该气体所含分子数为___________________NA。
(3)该气体在标准状况下的体积约为___________________L。
(4)其中氢原子数目与___________ gNH3中的氢原子数目相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是( )
A.某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有![]()
B.某溶液中加![]() 溶液生成白色沉淀,说明原溶液中有
溶液生成白色沉淀,说明原溶液中有![]()
C.某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有![]()
D.某溶液中加稀硫酸溶液生成无色无味气体,说明原溶液中有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天青石(主要含有SrSO4和少量CaCO3杂质)是获取锶元素的各种化合物的主要原料。请回答下列问题:
(1)利用焰色反应可以定性鉴别某些金属盐。灼烧SrSO4时,锶的焰色为_____(填标号)。 A.洋红色 B.浅紫色 C.黄绿色 D.淡蓝色
(2)硫化锶(SrS)可用作发光涂料的原料,SrSO4和碳的混合粉末在隔绝空气下高温焙烧可生成硫化锶和一种还原性气体, 该反应的化学方程式____________________________。
(3)已知:25℃时,K sp(SrSO4)=3.2×10-7,K sp(SrCO3)=1.1×10-10。SrSO4的粉末与Na2CO3溶液混合加热、充分搅拌可生成硫酸钠和碳酸锶,若转化完成时恢复到25℃,混合液中c(CO![]() )=1.0×10-3mol/L,则c(SO
)=1.0×10-3mol/L,则c(SO![]() )=______________________。
)=______________________。
(4)以天青石生产Sr(OH)2·xH2O的工艺如下:

已知: Sr(OH)2 、Ca(OH)2在水中的溶解度如下表:
温度/(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度(g) | Sr(OH)2 | 0.91 | 1.77 | 3.95 | 8.42 | 20.2 | 91.2 |
Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | |
①滤渣2为混有CaCO3的SrCO3,写出反应1生成SrCO3的化学方程式______________。
②固体3 “加热水浸”是为了获得较纯净的Sr(OH)2溶液/span>,此时应缓慢加热使沉淀颗粒长大,滤渣5的主要成分是______(填化学式),“趁热过滤”的目的是_________________________________。
③“操作6”主要有:________________、过滤、洗涤、干燥。
④取m g纯净Sr(OH)2·x H2O产品溶于水,加入过量Na2CO3溶液后过滤、洗涤、干燥后,得到n g滤渣,则x=__________(用含m、n的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com