
分析 (1)在一般的化合物中,H元素为+1价、O元素为-2价,各元素化合价的代数和为0,据此判断P元素化合价;得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂;
(2)H3PO2是一元中强酸可知,H3PO2是弱电解质,溶液中部分电离出氢离子;
(3)该反应中Ag元素化合价由+1价变为0价、P元素化合价由+1价变为+5价,转移电子数为4,根据转移电子守恒、电荷守恒及原子守恒配平方程式;
(4)该反应中电子从次磷酸转移到银离子,转移电子数为4;
(5)n(Ag)=$\frac{5.4g}{108g/mol}$=0.05mol,根据Ag和转移电子之间关系式计算;
(6)次磷酸(H3PO2)与D2O之间也能发生氢交换,但次磷酸钠(NaH2PO2)与D2O之间不能发生氢交换,说明次磷酸是一元酸,则次磷酸钠是正盐.
解答 解:(1)在一般的化合物中,H元素为+1价、O元素为-2价,各元素化合价的代数和为0,则P元素化合价为+1价;得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,所以H3PO2做是还原剂,故答案为:+1;还原剂;
(2)H3PO2是一元中强酸可知,H3PO2是弱电解质,溶液中部分电离出氢离子,其电离方程式为H3PO2?H++H2PO2-,
故答案为:H3PO2?H++H2PO2-;
(3)该反应中Ag元素化合价由+1价变为0价、P元素化合价由+1价变为+5价,转移电子数为4,根据转移电子守恒、电荷守恒及原子守恒配平方程式为4Ag++1H3PO2+2H2O=4Ag+1H3PO4+4H+,
故答案为:4;1;2;4;1;4;
(4)该反应中电子从次磷酸转移到银离子,转移电子数为4,用双线桥法在上式中标出电子转移的数目为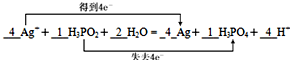 ,故答案为:
,故答案为: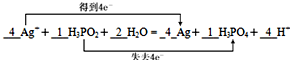 ;
;
(5)n(Ag)=$\frac{5.4g}{108g/mol}$=0.05mol,根据Ag和转移电子之间关系式得转移电子物质的量=0.05mol×(1-0)=0.05mol,转移电子数为0.05NA(或3.01×1022),故答案为:0.05NA(或3.01×1022);
(6)次磷酸(H3PO2)与D2O之间也能发生氢交换,但次磷酸钠(NaH2PO2)与D2O之间不能发生氢交换,说明次磷酸是一元酸,则次磷酸钠是正盐,次磷酸钠还含有钠离子,所以还属于钠盐,故选AC.
点评 本题考查氧化还原反应有关知识,为高频考点,涉及氧化还原反应方程式配平、方程式的有关计算、弱电解质的电离等知识点,明确各个物理量关系、氧化还原反应方程式配平规则、弱电解质电离特点是解本题关键,题目难度不大.


 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
| A. | 硝酸钠固体 | B. | 冰醋酸 | C. | 硫酸锌溶液 | D. | 硫酸铜固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | s区的元素都是活泼的金属元素 | B. | 所有的非金属元素都在p区 | ||
| C. | d区、ds区全是金属元素 | D. | 镧系、锕系元素都在f区 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇汽油是一种清洁能源,燃烧不会产生任何污染 | |
| B. | 在25℃、101KPa时,生成1mol水时放出683.4kJ的热量 | |
| C. | 乙醇的燃烧热为683.4kJ/mol | |
| D. | C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳离子只能得到电子被还原,作氧化剂 | |
| B. | 氧化还原反应的本质是元素化合价的升降 | |
| C. | 在氧化还原反应中,不一定所有元素的化合价都发生变化 | |
| D. | 氧化还原反应中,某元素由化合态变为游离态,此元素一定被还原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com