
| A、它为非金属 |
| B、其离子比Cu2+离子的氧化性强 |
| C、其低价氧化物是酸性氧化物 |
| D、它有+2价与+4价 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、制备硫酸亚铁铵的实验中最后制得的晶体过滤后用蒸馏水洗涤 |
| B、AgI 沉淀中滴入稀KCl溶液,有白色沉淀出现,说明AgCl比AgI更难溶 |
| C、倾析法是将不溶物充分沉淀后,先转移沉淀后转移液体 |
| D、配制好的氢氧化钠溶液用邻苯二甲酸氢钾滴定浓度时,采用酚酞为指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c (K+)>c (NO3-)>c (Ag+)=c (Cl-)+c (I-) |
| B、c (K+)>c (NO3-)>c (Ag+)>c (Cl-)>c (I-) |
| C、c (NO3-)>c (K+)>c (Ag+)>c (Cl-)>c (I-) |
| D、c (K+)>c (NO3-)>c (Cl-)>c (Ag+)>c (I-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
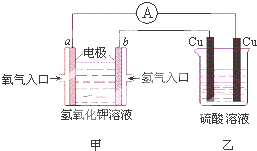 根据如图所示的装置(甲中电极均为惰性电极),判断下列叙述中正确的是( )
根据如图所示的装置(甲中电极均为惰性电极),判断下列叙述中正确的是( )| A、利用该反应可持续产生硫酸铜直至硫酸耗尽 | ||||
| B、甲中a电极的电极反应为:O2+4H++4e-=2H2O | ||||
C、装置开始工作初期乙中的总反应为:Cu+H2SO4
| ||||
| D、反应过程中甲、乙装置中溶液的pH都逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=6的溶液一定呈酸性 |
| B、25℃时,pH=7的一定是纯水 |
| C、溶于水呈中性的盐一定未发生水解 |
| D、酸碱恰好中和时,溶液不一定为中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5mol/L |
| B、6.25mol/L |
| C、6.5mol/L |
| D、8.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,16g14CH4所含中子数目为8NA |
| B、1 mol-CH3含有9 NA个电子 |
| C、常温常压下,44 g CO2气体含有氧原子的个数为2 NA |
| D、46gNO2和N2O4的混合物含有的原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氯甲烷有两种同分异构体 |
| B、丙烷的二氯代物有四种同分异构体,则其六氯代物也有四种同分异构体 |
| C、(CH3CH2)2CHCH3一氯取代物有两种同分异构体 |
| D、烷烃失去一个氢原子剩余的原子团叫烷基,苯环上的氢原子被烷基取代后、和苯分子相差若干CH2的物质是苯的同系物,则苯的同系物C8H10有三种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
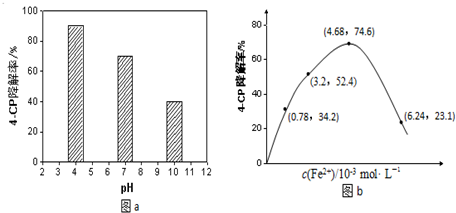
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com