
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为______________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是__________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是______________________________________________________。
②让反应停止的操作方法及原因是__________________________________________。
(4)以下收集NO气体的装置,合理的是________(填序号)。
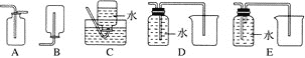
(5)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①NO的体积为________ L,NO2的体积为________ L。
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________ mol·L-1。
【答案】3Cu+8H++2NO![]() =3Cu2++4H2O+2NO↑ CD 2NO+O2=2NO2 接收被气体压出U形管的液体,防止稀硝酸溢出 关闭U形管右端导气管上的活塞;反应产生的气体将U形管右端管内的稀硝酸向下压,使铜丝与稀硝酸分开,反应就会停止 CD 5.8 5.4
=3Cu2++4H2O+2NO↑ CD 2NO+O2=2NO2 接收被气体压出U形管的液体,防止稀硝酸溢出 关闭U形管右端导气管上的活塞;反应产生的气体将U形管右端管内的稀硝酸向下压,使铜丝与稀硝酸分开,反应就会停止 CD 5.8 5.4 ![]()
【解析】
(1)金属铜和稀硝酸反应生成硝酸铜和NO气体;
(2)①由题意可知,这种成分不能与稀硝酸反应,而Fe、Al与硝酸反应,所以AB不行;
②二氧化氮是红棕色的气体,一氧化氮很容易和空气中的氧气化合,生成红棕色的二氧化氮气体;
(3)①为了证明产生的气体是NO,则该实验装置要防止产生的气体与空气接触,长玻璃管可以接收被气体压出U形管的液体,防止稀硝酸溢出;
②关闭U形管右端导气管上的活塞,反应产生的气体使稀硝酸液面下降,从而使铜丝与稀硝酸分开,反应停止;
(4)NO能与空气中的氧气反应,故不能用排空气法收集NO,只能用排水法收集;
(5)根据守恒的原理计算NO、NO2的体积,以及硝酸溶液的浓度。
(1)金属铜和稀硝酸反应生成硝酸铜和NO气体,反应的化学方程式:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O。
(2)①由题意可知,这种成分不能与稀硝酸反应,而Fe、Al与硝酸反应,所以AB不行,故答案为:CD。
②一氧化氮很容易和空气中的氧气化合,生成红棕色的二氧化氮气体,所以,制取一氧化氮的装置打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,发生2NO+O2═2NO2,
故答案为:2NO+O2═2NO2。
(3)①为了证明产生的气体是NO,则该实验装置要防止产生的气体与空气接触,长玻璃管可以接收被气体压出U形管的液体,防止稀硝酸溢出,故答案为:接收被气体压出U形管的液体,防止稀硝酸溢出。
②关闭U形管右端导气管上的活塞,反应产生的气体使稀硝酸液面下降,从而使铜丝与稀硝酸分开,反应停止,故答案为:关闭U形管右端导气管上的活塞;反应产生的气体将U形管右端管内的稀硝酸向下压,使铜丝与稀硝酸分开,反应就会停止。
(4)NO能与空气中的氧气反应,故不能用排空气法收集NO,只能用排水法收集,C和D装置符合题意,E装置是洗气装置,故答案为:CD。
(5)①设混合气中NO和NO2的物质的量分别是x和y。
则x+y=11.2L÷22.4L/mol=0.5mol ①
金属铜的物质的量是32.64g÷64g/mol=0.51mol
则根据电子的得失守恒可知n(e-)=3x+y=2n(Cu2+)=0.51mol×2 ②
由①、②解得x=0.26mol、y=0.24mol
所以NO和NO2的体积分别是0.26mol×22.4L/mol=5.8L,0.24mol×22.4L/mol=5.4L。
故答案为:5.8,5.4。
②溶液中的Cu2+全部转化成沉淀后,溶液中的溶质恰好是硝酸钠,
则根据原子守恒可知,硝酸钠的物质的量是0.001Vamol
所以原硝酸溶液的浓度为![]() =
=![]()
故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】下列实验现象描述正确的是( )
选项 | 实 验 | 现 象 |
A | 向饱和Na2CO3溶液中通入足量的CO2气体 | 无明显现象 |
B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝箔滴落下来 |
C | 向久置于空气中的FeSO4溶液中滴加NaOH溶液 | 立刻产生大量白色沉淀 |
D | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时火焰为黄色,燃烧后生成淡黄色固体 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学对社会发展与进步产生着巨大的贡献。德国化学家哈伯(F.Haber)的重要贡献是( )
A. 实验证实了夸克的存在
B. 发现了黄绿色气体氯气
C. 开发了合成氨的生产工艺
D. 提出了蛋白质分子的螺旋结构模型
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水;草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。装置C中可观察到的现象是____________,由此可知草酸晶体分解的产物中有_______。

装置B的主要作用是__________________。
(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置进行实验。


①乙组的实验装置中,依次连接的合理顺序为A→B→____→______→______→______→______→I。装置H反应管中盛有的物质是_________;I中集气瓶收集到的气体主要是_________。
②能证明草酸晶体分解产物中有CO的现象是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在500℃和催化剂存在的条件下,某固定容积的容器中发生放热反应2SO2(g)+O2(g) 2SO3(g)。下列说法正确的是
A.若降低温度,可以加快反应速率B.使用催化剂是为了加快反应速率
C.在上述条件下,SO2 能完全转化为SO3D.达到平衡时SO2和SO3的浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。其中A与B、A与D在周期表中位置相邻,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两种元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D四种元素电负性由大到小排列顺序为________________________________________。
(2)B的氢化物的结构是____________________________,其空间构型为____________________________________________________。
(3)E核外电子排布式是__________________,E的某种化合物的结构如下图所示。
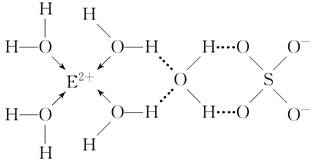
微粒间的相互作用包括化学键和分子间相互作用力,此化合物中各种粒子间的相互作用力有______________________。
(4)A与B的气态氢化物的沸点________更高,A与D的气态氢化物的沸点________更高。
(5)A的稳定氧化物中,中心原子的杂化类型为________,空间构型为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
① 含有大量AlO2-的溶液中,NH4+、NO3-、H+、Cl-可以大量共存
② 0.1 molL-1的AlCl3溶液中,Na+、K+、SO42-、HCO3-可以大量共存
③ 向AlCl3溶液中加入过量的稀氨水,发生反应:Al3++4NH3H2O=AlO2-+4NH4++2H2O
④ 加入铝粉能放出H2的溶液中,Ca2+、Fe2+、Cl-、NO3-一定能够大量共存
⑤ 用NaOH溶液除去铝条表面的氧化膜:Al2O3+2OH-=2AlO2-+H2O
⑥ 依据铝热反应原理,能发生反应2Al+3MgO![]() 3Mg+Al2O3
3Mg+Al2O3
⑦ 向明矾溶液中加入过量Ba(OH)2溶液,发生反应:2SO42-+2Ba2++Al3++4OH-=2BaSO4↓+AlO2-+2H2O
⑧ 常温下,铝可溶于过量浓硝酸,也可溶于过量NaOH溶液
A. ⑤⑦ B. ②③⑤ C. ④⑤⑥ D. ②⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置(X、Y是直流电源的两极)分别进行下列各组实验,则下表中各项所列对应关系均正确的一组是

选项 | X极 | 实验前U形管中液体 | 通电后现象及结论 |
A | 正极 | Na2SO4溶液 | U形管两端滴入酚酞后,a管中呈红色 |
B | 正极 | AgNO3溶液 | b管中电极反应式是4OH--4e-=O2↑+2H2O |
C | 负极 | CuCl2溶液 | b管中有气体逸出 |
D | 负极 | NaOH溶液 | 溶液PH降低 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com