
| A. | 丁烷 | B. | 异丁烷 | C. | CH3CH=CHCH3 | D. | CH2=CHCH2CH3 |
分析 在常见的有机化合物中甲烷是正四面体结构,乙烯和苯是平面型结构,乙炔是直线型结构,其它有机物可在此基础上进行判断.
解答 解:A、丁烷中四个碳与其它原子均为四面体构型,故四个碳原子不可能共平面,故A错误;
B、异丁烷中2号碳与其余三个碳处于四面体位置,故四个碳原子不可能共平面,故B错误;
C、此有机物相当于乙烯中的2个H分别被甲基取代生成的,即甲基取代H原子的位置,乙烯中六个原子共平面,故此有机物中四个碳原子可以共平面,故C正确;
D、此有机物相当于乙烯中的1个H被乙基取代生成的,即乙基取代H原子的位置,乙烯中六个原子共平面,故此有机物中三个碳原子可以共平面,最后一个甲基与前面的碳形成四面体结构,故四个碳不共平面,故D错误,
故选C.
点评 本题主要考查有机化合物的结构特点,做题时注意从甲烷、乙烯、苯和乙炔的结构特点判断有机分子的空间结构.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| 物质 | 杂质 | 所选试剂 | 方法 | |
| A | 乙烷 | 乙烯 | 酸性KMnO4溶液 | 洗气 |
| B | 溴苯 | 溴 | H2O | 萃取 |
| C | 乙炔 | 硫化氢 | 硫酸铜溶液 | 洗气 |
| D | 乙酸乙酯 | 乙酸 | 饱和Na2CO3溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
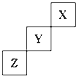 短周期元素X、Y、Z在周期表中位置关系如图所示,
短周期元素X、Y、Z在周期表中位置关系如图所示,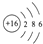 .写出Z单质与铁反应的化学反应方程式:Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS.
.写出Z单质与铁反应的化学反应方程式:Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石比石墨更稳定 | |
| B. | 石墨比金刚石更稳定 | |
| C. | 1 mol金刚石比1 mol石墨的总能量低 | |
| D. | 1 mol金刚石转变为石墨需要吸收1.895 kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
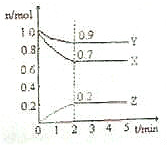 在一定条件下,N2(g)+H2(g)?2NH3(g),该反应的能量变化为放出92.4KJ热量,在容积为2升的密闭容器中,分别充入1molN2和1molH2,2min反应达到最大限度,三种气态物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
在一定条件下,N2(g)+H2(g)?2NH3(g),该反应的能量变化为放出92.4KJ热量,在容积为2升的密闭容器中,分别充入1molN2和1molH2,2min反应达到最大限度,三种气态物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,
,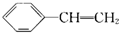 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | Ca2+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L-1 | 2×10-6 | 6×10-6 | 2×10-5 | 4×10-6 | 3×10-5 | 2×10-6 |
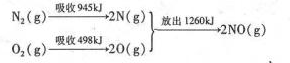
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com