
【题目】现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图,请计算出FeCl3、AlCl3的物质的量浓度各为多少? 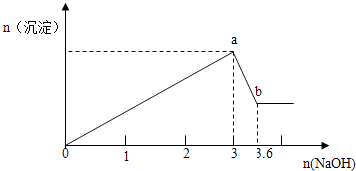
【答案】解:设n(Al3+)=n(Al(OH)3)=x,则由Al(OH)3+OH﹣═AlO2﹣+2H2O
11
x (3.6﹣3)mol
x=(3.6﹣3)mol=0.6mol,
设n(Fe3+)=y,则
Al3++3OH﹣═Al(OH)3↓
0.6mol1.8mol 0.6mol
Fe3++3OH﹣═Fe(OH)3↓
1 3
y(3﹣1.8)mol,![]() =
= ![]()
解得y=0.4mol,
c(FeCl3)= ![]() =4mol/L,
=4mol/L,
c(AlCl3)= ![]() =6mol/L,
=6mol/L,
答:FeCl3、AlCl3的物质的量浓度分别为4mol/L、6mol/L.
【解析】发生的反应有Fe3++3OH﹣═Fe(OH)3↓、Al3++3OH﹣═Al(OH)3↓、Al(OH)3+OH﹣═AlO2﹣+2H2O,结合图中消耗的NaOH的物质的量来计算即可.


科目:高中化学 来源: 题型:
【题目】某芳香烃X是一种重要的有机化工原料,分子式C7H8 . 现以它为初始原料设计出如图转化关系图(部分产物、合成路线、反应条件略去).其中A是一氯代物,F的分子式为C7H7NO2 , Y是一种功能高分子材料.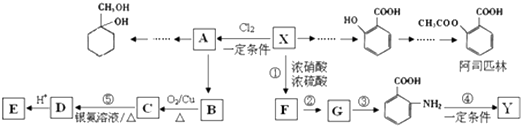
已知下列信息:
①烷基苯在高锰酸钾的作用下,侧链被氧化成羧基 ![]()
② ![]() (苯胺,易被氧化)
(苯胺,易被氧化)
请根据本题所给信息与所学知识回答下列问题:
(1)X的结构简式是 , 其核磁共振氢谱图有个吸收峰;
(2)有机物C的结构简式是;
(3)阿司匹林分子中含有的官能团的名称是;1mol阿司匹林与足量NaOH溶液反应最多消耗NaOH的物质的量为mol;
(4)Y的结构简式为;
(5)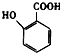 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有种;
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有种;
(6)以下是由A和其他物质合成 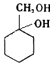 的流程:A
的流程:A ![]() 甲→乙
甲→乙 ![]()
![]()
![]()
![]() 甲→乙反应的化学方程式为 .
甲→乙反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.少量金属钠加到冷水中:Na+2H2O═Na++2OH﹣+H2↑
B.NaHCO3溶液中滴加少量Ca(OH)2溶液:Ca2++OH﹣+HCO ![]() ═CaCO3↓+H2O
═CaCO3↓+H2O
C.硫酸铝溶液中加入过量氨水:Al3++4NH3?H2O═AlO ![]() +4NH
+4NH ![]() +2H2O
+2H2O
D.将2 mol/L? AlCl3溶液和7 mol/L? NaOH溶液等体积混合:2Al3++7OH﹣═Al(OH)3↓+AlO ![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CaSO4受热分解,由于受热温度不同,气体成分也不同.气体成分可能为SO2、SO3和O2中的一种、二种或三种.某化学课外活动小组准备通过系列实验探究CaSO4分解生成的气体,进而确定CaSO4分解的化学方程式.
(1)[提出猜想]Ⅰ.所得气体的成分可能只含SO3一种;
Ⅱ.所得气体的成分可能含有二种;(填分子式)
(2)Ⅲ.所得气体的成分可能含有 SO2、SO3、O2三种.[设计实验]
该化学课外活动小组准备通过测定D装置的增重以及量筒中水的体积,来探究CaSO4分解生成的气体成分,进而确定CaSO4分解的化学方程式.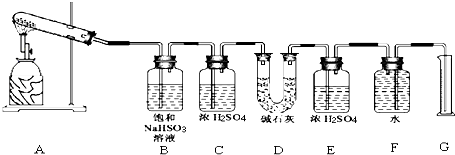
[实验过程]
根据上述实验方案进行试验.已知实验结束时,CaSO4完全分解.
请结合以下实验现象和记录的实验数据进行分析:
①若实验结束时,G中量筒没有收集到水,则证明猜想正确.(填Ⅰ或Ⅱ或Ⅲ)
②若实验结束时,装置D的总质量增加,能否断定气体产物中一定含有SO2而不含SO3?请说明理由: .
③该实验设计中,容易给测定带来较大误差的因素有 .
(写出一种即可)
④经改进后,有两组同学进行该实验,由于加热时的温度不同,实验测得数据也不同,
相关数据如下:
实验小组 | 称取CaSO4 | 装置D增加 | 量取气体体积的装置测量的气体体积 (折算成标准状况下气体的体积) (mL) |
一 | 4.08 | 2.56 | 224 |
二 | 5.44 | 2.56 | 448 |
请通过计算,推断第二组同学得出的CaSO4分解的化学反应方程式:
第二组: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.干冰升华要吸收大量的热,属于化学反应中的吸热反应
B.人们用氧炔焰焊接或切割金属,主要是利用了乙炔燃烧时所放出的热量
C.木炭常温下不燃烧,加热才能燃烧,说明木炭燃烧是吸热反应
D.NaOH固体溶于水后温度升高,说明NaOH的溶解只有放热过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素A、B、C、D的性质或结构信息如下:信息①原子半径大小:A>B>C>D
信息②四种元素之间形成的某三种分子的比例模型及部分性质:
请根据上述信息回答下列问题.
(1)B元素在周期表中的位置;
(2)BC2分子的电子式;
(3)A元素的单质与物质甲发生反应的离子方程式;
(4)丙的钠盐溶液呈性,用化学用语表示其原因;
(5)物质丁的元素组成和甲相同,丁分子具有18电子结构.向盛有一定浓度丁溶液的试管中,逐滴加入用少量稀硫酸酸化的硫酸亚铁溶液.滴加过程中的现象是:①浅绿色溶液变成深棕黄色;
②有少量气泡出现(经验证是氧气),片刻后反应变得剧烈 , 并放出较多热量,继续滴加溶液,静置一段时间;
③试管底部出现红褐色沉淀 . 向浊液中再滴入稀硫酸,沉淀溶解,溶液呈黄色.
请用化学方程式或离子方程式及必要的文字解释①、②、③中划线的字.
①;
②;
③ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施中,不能增大化学反应速率的的是
A.Zn与稀硫酸反应制取H2时,加入蒸馏水
B.Al在O2中燃烧生成Al2O3时,用铝粉替代铝片
C.CaCO3与稀盐酸反应生成CO2时,适当升高温度
D.用KClO3固体分解制取O2时,固体中添加少量MnO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( ) 
A.分子式为C7H6O5
B.分子中含有2种官能团
C.可发生加成和取代反应
D.在水溶液中羟基和羧基均能电离出氢离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用如图所示装置进行探究实验.以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色. 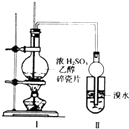
(1)写出该实验中生成乙烯的化学方程式:
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是 .
A.乙烯与溴水易发生取代反应
B.使溴水褪色的物质,未必是加成反应
C.使溴水褪色的物质,未必是乙烯
(3)乙同学经过细致观察后认为:
试管中另一现象可证明反应中有乙烯生成,这个现象是 . 为验证这一反应是加成而不是取代,可用PH试纸来测试反应后溶液的酸性,理由是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com