
��8�֣���1������δ����õ���Դѡ����ȡ�����ij���ķ����кܶ࣬���ü״�������ˮ������Ӧ������������Ӧ����ʽ���£�
CH3OH(g) + H2O(g)  CO2(g) + 3H2(g)
CO2(g) + 3H2(g) 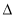 H(298K)��+ 49.4 kJ/mol
H(298K)��+ 49.4 kJ/mol
һ�������£����ݻ�Ϊ2L�ĺ����ܱ������г���1 mol CH3OH(g)��3 mol H2O(g)��ʵ���ã��ﵽƽ��״̬ʱ����������19.76 kJ����
�ٴ�ƽ��ʱ��������ѹǿ�Ƿ�Ӧǰ�� ����
�ڸ������µĸ÷�Ӧ��ƽ�ⳣ���� �����������λ��Ч���֣���
�۸������·�Ӧ��ƽ��״̬�������ǣ�����ţ� ��
A��v��(CH3OH)��v��(CO2) B�����������ܶȲ���
C��c(CH3OH)��c(H2O) D���������������ʵ�������
��2�� �ס��������������ȣ�������ͨ��1 mol SO2��1 mol O2��������ͨ��1 mol SO3��0.5 mol O2��������Ӧ��2SO2(g) + O2 (g)  2SO3(g)
2SO3(g)  H��0���ס�����ʼ��Ӧ�¶���ͬ���������������������ƽ��ʱ������SO2��ת����Ϊa������SO3�ķֽ���Ϊb����a��b�Ĺ�ϵΪa+b _______ 1�������������������) ��
H��0���ס�����ʼ��Ӧ�¶���ͬ���������������������ƽ��ʱ������SO2��ת����Ϊa������SO3�ķֽ���Ϊb����a��b�Ĺ�ϵΪa+b _______ 1�������������������) ��
�� �� 1.2 ��2�֣� �� 0.11 mol2/L2 ��2�֣� �� D ��2�֣� ���� ����2�֣���
��������
�����������1���ٸ��ݷ�Ӧ����ʽ��֪������1mol�ļ״���Ӧ����ų�����49.4 kJ������1 mol CH3OH(g)��3 mol H2O(g)����Ӧ�ų�������19.76 kJ��������Ӧ�ļ״������ʵ�����19.76��49.4=0.4mol.��ﵽƽ���Ǹ�����������ʵ����Ǽ״���0.6mol��H2O(g)��2.6mol; CO2(g) ��0.4mol, H2(g) ��1.2mol.ƽ��������������ʵ�����4.8mol���ں��ݵ��ܱ������ڡ���������ʵ����ıȵ������ǵ�ѹǿ֮�ȣ���� ��ƽ��ʱ��������ѹǿ�Ƿ�Ӧǰ��4.8mol��4mol=1.2�����ڸ������µĸ÷�Ӧ��ƽ�ⳣ��K=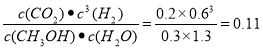 mol2/L2����A.����CH3OH��CO2һ���Ƿ�Ӧ�һ������������ߵ�ϵ����ͬ���������κ�����£�������v��(CH3OH)��v��(CO2)���ʲ�����Ϊ�жϸ������·�Ӧ��ƽ��״̬�����ݣ�����B�����ڷ�Ӧǰ��������������䣬���Ҳ���䣬�������۷�Ӧ�Ƿ�ﵽƽ�⣬���������ܶȶ����䣬�ʲ�����Ϊ�жϸ������·�Ӧ��ƽ��״̬�����ݣ�����C�����ڼ���Ķ��ߵ����ʵ����ı���1:3��������Ӧʱ���ĵ����ʵ����ı���1:1������c(CH3OH)�� c(H2O)��������ȣ��ʲ�����Ϊ�жϸ������·�Ӧ��ƽ��״̬�����ݣ�����D�����ڸ÷�Ӧ�Ƿ�Ӧǰ����������ʵ������ȣ����Ի������������ʵ������䣬˵����Ӧ�ﵽƽ��״̬��������Ϊ�жϸ������·�Ӧ��ƽ��״̬�����ݣ���ȷ����2�����練Ӧ�Ǵ�����Ӧ����ʼ�ģ�����������Ŀ�ʼ״̬��ͬ���ס�����ʼ��Ӧ�¶���ͬ���������������������ƽ��ʱ������SO2��ת����Ϊa������SO3�ķֽ���Ϊb����a��b�Ĺ�ϵΪa+b=1�����Ǹ���ϵ�������������������������������������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ�������ƽ��ʱ������SO2��ת����Ϊa������SO3�ķֽ���Ϊb����a��b�Ĺ�ϵ��С���������������������a+b<1.
mol2/L2����A.����CH3OH��CO2һ���Ƿ�Ӧ�һ������������ߵ�ϵ����ͬ���������κ�����£�������v��(CH3OH)��v��(CO2)���ʲ�����Ϊ�жϸ������·�Ӧ��ƽ��״̬�����ݣ�����B�����ڷ�Ӧǰ��������������䣬���Ҳ���䣬�������۷�Ӧ�Ƿ�ﵽƽ�⣬���������ܶȶ����䣬�ʲ�����Ϊ�жϸ������·�Ӧ��ƽ��״̬�����ݣ�����C�����ڼ���Ķ��ߵ����ʵ����ı���1:3��������Ӧʱ���ĵ����ʵ����ı���1:1������c(CH3OH)�� c(H2O)��������ȣ��ʲ�����Ϊ�жϸ������·�Ӧ��ƽ��״̬�����ݣ�����D�����ڸ÷�Ӧ�Ƿ�Ӧǰ����������ʵ������ȣ����Ի������������ʵ������䣬˵����Ӧ�ﵽƽ��״̬��������Ϊ�жϸ������·�Ӧ��ƽ��״̬�����ݣ���ȷ����2�����練Ӧ�Ǵ�����Ӧ����ʼ�ģ�����������Ŀ�ʼ״̬��ͬ���ס�����ʼ��Ӧ�¶���ͬ���������������������ƽ��ʱ������SO2��ת����Ϊa������SO3�ķֽ���Ϊb����a��b�Ĺ�ϵΪa+b=1�����Ǹ���ϵ�������������������������������������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ�������ƽ��ʱ������SO2��ת����Ϊa������SO3�ķֽ���Ϊb����a��b�Ĺ�ϵ��С���������������������a+b<1.
���㣺�������������ƽ����ƶ������ʵ�ת���ʵ�Ӱ�졢ƽ��״̬���жϡ����ʵ�ת���ʡ�ƽ�ⳣ���ļ����֪ʶ��


 ��ʱѵ���������������ϵ�д�
��ʱѵ���������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015�����ʡ�����и�����һ��ģ�⿼�Ի�ѧ�Ծ��������棩�� ���ͣ������
��ÿ��2�֣���ͼ3�֣���13�֣�ij�ᾧˮ���ﺬ�����������Ӻ�һ�������ӡ���ȡ����������Ϊ45.3g�ĸýᾧˮ����ֱ��Ƴ���Һ��������һ����μ���NaOH��Һ����ʼ������Һ�г��ְ�ɫ�����������ࣻһ��ʱ����������ݳ����������д̼�����ζ����ʹʪ��ĺ�ɫʯ����ֽ���������Ⱥƿ��ռ���2.24L�����壨��״����������ɫ�������ٲ�������ʧ����һ����μ���Ba(OH)2��Һ����ʼ�������ƣ����������а�ɫ���������ˣ���ϡ���ᴦ���������ϴ�Ӻ���õ���ɫ����46.6 g��
��ش��������⣺
��1���ýᾧˮ�����к��е�������������Al3+��________����������________��
��2����ͨ������ȷ����n(Al3+)��________���ýᾧˮ����Ļ�ѧʽ________ ��
��3����������������Һ�м����Ba(OH)2��Һ�����ʵ���Ũ��Ϊ2.0mol/L��
�ټ��� mLBa(OH)2��Һʱ�����ó����������ʵ������
��������ͼ�л������ɳ��������ʵ��������Ba(OH)2��Һ����Ĺ�ϵʾ��ͼ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ������һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����( )
A��H��D��T����ͬλ�أ�H2��D2��T2����ͬ��������
B����ˮ����ˮ����ˮ�ǻ���ˮ����ˮ�����Ǵ�����
C�������ᡢ���С�մ�ֱ������ᡢ���
D��ˮ�ܡ����ܡ����������ǿ�������Դ��ú��ʯ�͡���Ȼ���Dz���������Դ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���з�Ӧ�У�����ȡ����Ӧ���� ( )
��CH3CH=CH2 + Br2 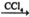 CH3CHBrCH2Br
CH3CHBrCH2Br
��CH3CH2OH  CH2=CH2 + H2O
CH2=CH2 + H2O
��CH3COOH + CH3CH2OH  CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
��C6H6 + HNO3  C6H5NO2+H2O
C6H5NO2+H2O
A���٢� B���٢� C���ڢ� D���ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ������ѧ����㿼�Ի�ѧ�Ծ��������棩 ���ͣ������
��ѡ��3�����ʽṹ�����ʡ���15�֣�
��1����ͭ���ӣ�Cu+����̬ʱ�ļ۵����Ų�ʽ��ʾΪ ��
��2����Ϊ��4����Ԫ�أ����ڵ�Ԫ��������壬��3��Ԫ�صĵ�һ�����ܴӴ�С˳��Ϊ ����Ԫ�ط��ű�ʾ����
��3��Cu����Ķѻ���ʽ�� ����ѻ���ʽ���ƣ�������λ��Ϊ ����Cu����������Һ�м��������ˮ��������[Cu(NH3)4]SO4������˵����ȷ����_____
A��[Cu (NH3)4]SO4�������Ļ�ѧ�������Ӽ������Լ�����λ��
B����[Cu(NH3)4 ]2+��Cu2+�����¶Ե��ӣ�NH3�ṩ�չ��
C��[Cu (NH3)4]SO4���Ԫ���е�һ��������������Ԫ��
D��SO42-��PO43-��Ϊ�ȵ����壬�ռ乹�;�Ϊ��������
��4����������ͭ�ķ��ӽṹ��ͼ��̼ԭ�ӵ��ӻ���ʽΪ ��
��5��CuԪ����HԪ�ؿ��γ�һ�ֺ�ɫ������侧��ṹ��Ԫ����ͼ��ʾ����û�����Ļ�ѧʽΪ ��
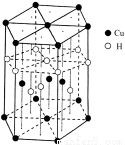
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ������ѧ����㿼�Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͼ��һ��Ӧ�ù㷺��﮵�أ�LiPF6�ǵ���ʣ�SO(CH3)2���ܼ�����Ӧԭ����4Li+FeS2��Fe+2Li2S������˵������ȷ����

A��������ˮ����SO(CH3)2���ܼ� B�������ƶ���������a������b��
C����װ�ý���ѧ��ת��Ϊ���� D��b����Ӧʽ��FeS2��4Li+��4e-��Fe��2Li2S
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ������ѧ����㿼�Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����й�ʵ������У���ȷ����
A�����Թ�ȡ���Լ�ƿ�е�NaOH��Һ������ȡ�����࣬Ϊ�˲��˷ѣ��ְѹ������Լ������Լ�ƿ��
B��������Ӧʵ���ķ�Һ���ȵ���ˮ���У�����ˮ������ˮ��
C�����Թ��еμ�Һ��ʱ����ͷ�ιܱ�������Թ��ڱڣ�����Һ�彦��
D����Ũ��������һ�����ʵ���Ũ�ȵ�ϡ����ʱ��Ũ��������ˮ��Ӧ��ȴ�����²���ת�Ƶ�����ƿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ��������У�߶���ѧ������������ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ�������ȷ���ǣ� ��
A���ڴ������ڵ������£�������ˮ������Ӧ��������ɫ��ˮ�ص�Һ���屽
B�����Թ����ȼ���һ����Ũ���ᣬ�����μ�������Ũ����ͱ���Ȼ�������ȡ������
C��ʵ������ȡ��Ȳʱ���ñ���ʳ��ˮ��������ˮ���Եõ�ƽ�ȵ�����
D����֤������ˮ�����ʱ���������������������Һ��ϣ��������Һ�����ã���Һ��ֲ�μ���������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ������ѧ����㿼�Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪AgCl��AgBr���ܽ�ȷֱ�Ϊ1.5��10-4g��8.4��10-6 g��20�棩����AgCl��AgBr�ı�����Һ�������ϣ��ټ���������Ũ��������Һ�������ķ�ӦΪ(����)��
A.ֻ��AgBr�������� B. AgCl��AgBr������������
C. AgCl��������AgBr���� D. AgCl��������AgBr����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com