
氨气在工农业有着广泛的用途。已知25%氨水的密度为0.91 g/cm3,5%氨水的密度为0.98 g/cm3。
1、(1)配制100mL 2.5mol/L氨水需要浓度为25%氨水______mL(保留2位小数)。
(2)若将上述两溶液等体积混合,所得氨水溶液的质量分数是_____________。
A.等于15% B.大于15% C.小于15% D.无法估算
2、已知:4NH3+O2 4NO+6NO,4NO+3O2+2H2O
4NO+6NO,4NO+3O2+2H2O 4HNO3
4HNO3
设空气中氧气的体积分数为0.20,氮气的体积分数为0.80。
(1)a mol NO完全转化为HNO3理论上需要氧气_____________mol。
(2)为使NH3恰好完全氧化为NO,氨-空气混合气体中氨的体积分数(用小数表示)为_____________ (保留2位小数)。
(3)20.0 mol NH3用空气氧化,产生混合物的组成为:NO 18.0 mol、O2 12.0 mol、N2 150.0 mol和一定量硝酸,以及其他成分(高温下NO与O2不化合)。计算氨转化为NO和HNO3的转化率。
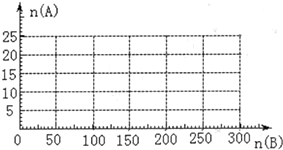
(4)20.0 mol NH3和一定量空气充分反应后,再转化为硝酸。通过计算,在图中画出HNO3的物质的量n(A)和空气的物质的量n (B)关系的理论曲线。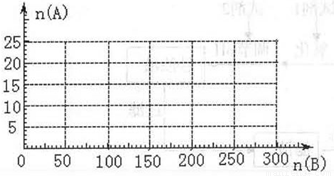
1、(1)18.68mL (2)C
2、(1)0.75a (2)0.14
(3)97. 5%
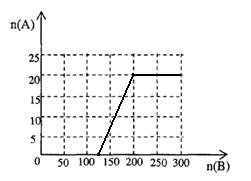
(4)
【解析】
试题分析:
1、(1)先计算25%的氨水的浓度,c=1000*0.91*0.25/17=13.38mol/L。则需要的氨水的体积为0.1*2.5/13.38=0.01868L,即为18.86ml
(2)令氨水的体积为1ml,则:
质量分数为25%的氨水的质量为1ml×0.91g/cm3=0.91g,溶质氨气的质量为0.91g×25%g
质量分数为5%的氨水的质量为1ml×0.98g/cm3=0.98g,溶质氨气的质量为0.98g×5%g
所以混合后氨水的质量分数为(0.91g×25%g+0.98g×5%g)/(0.91g+0.98g) ×100%=14.63%<15%。
2、
(1)4NO + 3O2+2H2O ==4HNO3
4mol 3mol
amol 0.75amol
所以需要氧气为0.75amol。
(2)假设氨气的体积是4L,设需要空气的体积为y,
4NH3+5O2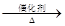 4NO+6NO
4NO+6NO
4 5
4L 0.020y
y=4×5/(4×0.20)="25L," 氨-空气混合物中氨的体积分数=4L/(4L+25L)=0.14
(3)设生成x mol HNO3,空气中氮气的量是氧气的4倍,4(2x+18.0×(5/4)+12.0)=150.0 x=1.5mol
根据氮原子守恒,NH3的转化为HNO3的转化率=1.5mol/20mol×100%=7.5%
NH3的转化为NO的转化率=(18.0+1.5)/20×100%=97.5%
所以氨转化为NO和HNO3的转化率分别是7.5%和97.5%.
(4)20.0mol NH3为NO,需要空气n(B)= 20.0×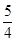 ×5=125mol
×5=125mol
20.0mol NO完全转化HNO3,又需要空气n(B)= 20.0×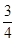 ×5=75mol
×5=75mol
所以硝酸最大值为20mol,此时空气为200mol。
考点:物质的量计算,氨和氨的化合物性质。
点评:本题涉及到了很多物质的量的计算,需要学生能够熟练掌握,另外根据方程式计算也有一定的难度,特别是最后一问的图像题目,需要画出最大值,再确定起点,才能完成这一题。本道综合体难度较大。


科目:高中化学 来源: 题型:
| 催化剂 | △ |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市青浦区高三上学期期末教学质量调研化学试卷(解析版) 题型:计算题
(1)氨气在工农业有着广泛的用途。已知25%氨水的密度为0.91 g/cm3,5%氨水的密度为0.98 g/cm3。
①配制100mL 2.5mol/L氨水需要浓度为25%氨水______mL(保留2位小数)。
②若将上述两溶液等体积混合,所得氨水溶液的质量分数是_____________。
A.等于15% B.大于15% C.小于15% D.无法估算
已知:4NH3+O2 4NO+6 H2O,4NO+3O2+2H2O
4NO+6 H2O,4NO+3O2+2H2O 4HNO3
4HNO3
(2)设空气中氧气的体积分数为0.20,氮气的体积分数为0.80。
①a mol NO完全转化为HNO3理论上需要氧气_____________mol。
②为使NH3恰好完全氧化为NO,氨-空气混合气体中氨的体积分数(用小数表示)为_____________
(保留2位小数)。
(3)20.0 mol NH3用空气氧化,产生混合物的组成为:NO 18.0 mol、O2 12.0 mol、N2 150.0 mol和一定量硝酸,以及其他成分(高温下NO与O2不化合)。计算氨转化为NO和HNO3的转化率。
(4)20.0 mol NH3和一定量空气充分反应后,再转化为硝酸。通过计算,在图中画出HNO3的物质的量n(A)和空气的物质的量n (B)关系的理论曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 4NO+6H2O,4NO+3O2+2H2O→4HNO3
4NO+6H2O,4NO+3O2+2H2O→4HNO3
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市青浦区高三(上)期末暨高考化学一模试卷(解析版) 题型:解答题
 4NO+6H2O,4NO+3O2+2H2O→4HNO3
4NO+6H2O,4NO+3O2+2H2O→4HNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com