
【题目】为解决“温室效应”日趋严重的问题,科学家们不断探索CO2的捕获与资源化处理方案,利用CH4捕获CO2并转化为CO和H2混合燃料的研究成果已经“浮出水面”。
已知:①CH4(g)十H2O(g)=CO(g)+3H2(g) △H1=+206.4kJ/mol
②CO(g)+H2O(g)=CO2(g)+H2(g) △H2=-41.2kJ/mol
T1℃时,在2L恒容密闭容器中加入2molCH4和1molCO2,并测得该研究成果实验数据如下:
时间/s | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
CO2/mol | 1 | 0.7 | 0.6 | 0.54 | 0.5 | 0.5 | 0.5 |
H2/mol | 0 | 0.6 | 0.8 | 0.92 | 1 | 1 | 1 |
请回答下列问题:
(1)该研究成果的热化学方程式③CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=__。
(2)30s时CH4的转化率为__,20~40s,v(H2)=__。
(3)T2℃时,该反应的化学平衡常数为1.5,则T2__T1(填“>”“=”或“<”。)
(4)T1℃时反应③达到平衡的标志为__。
A.容器内气体密度不变
B.体系压强恒定
C.CO和H2的体积分数相等且保持不变
D.2v(CO)逆=v(CH4)正
(5)上述反应③达到平衡后,其他条件不变,在70s时再加入2molCH4和1molCO2,此刻平衡的移动方向为__(填“不移动”“正向
(6)由图可知反应在t1、t2、t3时都达到了平衡,而在t2、t4、t8时都改变了条件,试判断t2时改变的条件可能是__。若t4时降低温度,t5时达到平衡,t6时增大了反应物浓度,请补t4~t6时逆反应速率与时间的关系曲线___。

【答案】+247.6kJ/mol 23% 0.005mol/(Ls) > BC 正向 小 加压或增大生成物浓度 
【解析】
已知:①CH4(g)十H2O(g)=CO(g)+3H2(g) △H1=+206.4kJ/mol
②CO(g)+H2O(g)=CO2(g)+H2(g) △H2=-41.2kJ/mol
(1)利用盖斯定律,将①-②,可得出热化学方程式③CH4(g)+CO2(g)=2CO(g)+2H2(g) △H。
(2)利用三段式,建立各物质的起始量、变化量与平衡量的关系,可得出30s时CH4的转化率,20~40s的v(H2)。
(3)利用三段式,可求出T1时的化学平衡常数,与T2时进行比较,得出T2与T1的关系。
(4)A.气体的质量不变,容器的体积不变,则容器内气体密度始终不变;
B.容器的体积不变,气体的分子数随反应进行而发生变化;
C.平衡时,CO和H2的体积分数保持不变;
D.2v(CO)逆=v(CH4)正,方向相反,但数值之比不等于化学计量数之比。
(5)利用浓度商与平衡常数进行比较,可确定平衡移动的方向;利用等效平衡原理,可确定CO2的总转化率与原平衡时的关系。
(6)从图中可以看出,改变某条件,此时逆反应速率瞬间增大,但平衡逆向移动,对温度、压强、浓度进行验证,确定适宜的条件。并画出坐标图。
已知:①CH4(g)十H2O(g)=CO(g)+3H2(g) △H1=+206.4kJ/mol
②CO(g)+H2O(g)=CO2(g)+H2(g) △H2=-41.2kJ/mol
(1)利用盖斯定律,将①-②,可得出热化学方程式③CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=+247.6kJ/mol。答案为:+247.6kJ/mol;
(2)利用表中数据,建立如下三段式:

30s时,CH4的转化率为![]() =23%,20~40s的v(H2)=
=23%,20~40s的v(H2)=![]() = 0.005mol/(Ls)。答案为:23%;0.005mol/(Ls);
= 0.005mol/(Ls)。答案为:23%;0.005mol/(Ls);
(3)利用平衡时的数据,可求出T1时的化学平衡常数为![]() =
=![]() <1.5,则由T1到T2,平衡正向移动,从而得出T2>T1。答案为:>;
<1.5,则由T1到T2,平衡正向移动,从而得出T2>T1。答案为:>;
(4)A.容器内气体密度始终不变,则密度不变时,不一定达平衡状态,A不合题意;
B.气体的分子数随反应进行而发生改变,则压强随反应进行而改变,压强不变时达平衡状态,B符合题意;
C.平衡时,CO和H2的体积分数保持不变,反应达平衡状态,C符合题意;
D.2v(CO)逆=v(CH4)正,方向相反,但数值之比不等于化学计量数之比,反应未达平衡,D不合题意;
故选BC。答案为:BC;
(5)平衡时加入2molCH4和1molCO2,浓度商为Q=![]() =
=![]() <
<![]() ,所以平衡正向移动;加入2molCH4和1molCO2,相当于原平衡体系加压,平衡逆向移动,CO2的总转化率比原平衡小。答案为:正向;小;
,所以平衡正向移动;加入2molCH4和1molCO2,相当于原平衡体系加压,平衡逆向移动,CO2的总转化率比原平衡小。答案为:正向;小;
(6)从图中可以看出,t2时改变某条件,此时逆反应速率瞬间增大,平衡逆向移动,则此条件应为加压或增大生成物浓度。若t4时降低温度,则平衡逆向移动,v逆减小,t5时达到平衡,t6时增大了反应物浓度,此时v逆不变,则t4~t6时逆反应速率与时间的关系曲线为 。答案为:加压或增大生成物浓度;
。答案为:加压或增大生成物浓度; 。
。


科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示。下列说法正确的是

A.温度:a>b>c
B.仅升高温度,可从a点变为c点
C.水的离子积常数Kw:b>c>d
D.b点对应温度下,0.5 mol/L H2SO4溶液与1mol/L KOH溶液等体积混合,充分反应后,所得溶液中c(H+) = 1.0×10-7 mol L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是( )
A.高温能使合成氨的反应速率加快
B.H2、I2、HI平衡时的混合气体加压后颜色变深
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.红棕色的NO2加压后颜色先变深后变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化合物SOCl2是一种液态化合物,沸点为77℃,在盛有10mL水的锥形瓶中小心滴加8~10滴SOCl2,可观察到剧烈水解反应,液面有白雾和带有刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色。轻轻振荡锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出。
①根据上述实验,写出SOCl2和水反应的化学方程式____。
②AlCl3溶液蒸干灼烧得不到无水AlCl3,而用SOCl2与AlCl3·6H2O混合共热,可得到无水AlCl3,其原因是____。
(2)25℃时,将amol/L氨水与0.01mol/L盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显__(填“酸”、“碱”或“中”)性。
(3)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时溶液中![]() __。
__。
[已知Ksp(BaCO3)=2.2×10–9,Ksp(BaSO4)=1.1×10–10]。
(4)次磷酸(H3PO2)是一种精细化工产品。常温下,K(H3PO2)=1×10–2,0.1mol/L的H3PO2溶液在加水稀释过程中,下列表达式的数据一定变小的是_。(填序号)
A.c(H+) B.![]() C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

①滴定醋酸的曲线是____(填“I”或“II”)。
②V1和V2的关系:V1____V2(填“>”、“=”或“<”)。
③M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是____。
(2)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。查阅资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN>AgI。
操作步骤 | 现象 |
步骤1:向2mL0.005mol/LAgNO3溶液中加入2mL0.005mol/LKSCN溶液,静置。 | 出现白色沉淀 |
步骤2:取1mL上层清液于试管中,滴加1滴mol/LFe(NO3)3溶液。 | 溶液变红色 |
步骤3:向步骤2的溶液中,继续加入5滴3mol/LAgNO3溶液。 | 现象a,溶液红色变浅 |
步骤4:向步骤1中余下的浊液中加入5滴3mol/LKI溶液。 | 出现黄色沉淀 |
①写出步骤2中溶液变红色的离子方程式____。
②步骤3中现象a是____。
③用化学平衡原理解释步骤4的实验现象____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下物质的转化关系图,回答有关问题:
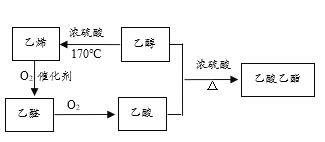
(1)上述物质中,_________(填结构简式,下同)的产量是衡量一个国家石油化工发展水平的标志;常见的酸性调味品中含有3%~5%的_________;具有香味的油状液体是_____________。
(2)乙醇中![]() 官能团名称是______,比乙醇少一个碳原子的同系物的结构简式是______。
官能团名称是______,比乙醇少一个碳原子的同系物的结构简式是______。
(3)生成乙酸乙酯的化学方程式是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 互为同分异构体,下列说法不正确的是
互为同分异构体,下列说法不正确的是
A. z的二氯代物有三种
B. x、y的一氯代物均只有三种
C. x、y 可使溴的四氯化碳溶液因发生加成反应而褪色
D. x、y、z中只有x的所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学研究证明:核外电子的能量不仅与电子所处的电子层、能级有关,还与核外电子的数目及核电荷数有关。氩原子与硫离子的核外电子排布相同,都是![]() 。下列说法正确的是( )
。下列说法正确的是( )
A.两粒子的1s能级上电子的能量相同
B.两粒子的3p能级上的电子离核的距离相同
C.两粒子的电子发生跃迁时,产生的光谱不同
D.两粒子最外层都达8电子稳定结构,化学性质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿巴卡韦(Abacavir)是一种核苷类逆转录酶抑制剂,存在抗病毒功效。关于其合成中间体 M(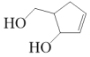 ),下列说法正确的是( )
),下列说法正确的是( )
A.与环戊醇互为同系物B.分子中含有三种官能团
C.能使酸性高锰酸钾溶液和溴水褪色,且原理相同D.可用碳酸钠溶液鉴别乙酸和 M
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com