
【题目】下列事实能用勒夏特列原理解释的是( )
A.高温能使合成氨的反应速率加快
B.H2、I2、HI平衡时的混合气体加压后颜色变深
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.红棕色的NO2加压后颜色先变深后变浅
科目:高中化学 来源: 题型:
【题目】利用付-克反应可制备芳香族化合物,如:![]() +C4H9Cl
+C4H9Cl![]() +HCl↑。下列有关说法不正确的是
+HCl↑。下列有关说法不正确的是
A.该反应为取代反应
B.![]() 属于烃的衍生物
属于烃的衍生物
C.分子式为C4H9Cl的物质有4种
D.![]() 能发生加成反应
能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是

A. WZ的水溶液呈碱性
B. 元素非金属性的顺序为X>Y>Z
C. Y的最高价氧化物的水化物是中强酸
D. 该新化合物中Y不满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语中正确的是( )
A.Na2S的水解:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
B.NaHCO3的电离:NaHCO3![]() Na++H++CO32-
Na++H++CO32-
C.HSO3-的电离:HSO3-![]() H++SO32-
H++SO32-
D.硫氢化钠溶液呈碱性:HS-+H2O![]() S2-+H3O+
S2-+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 是原子序数依次增大的短周期主族元素,X、Y 的最外层电子数均是其内层电子数的 ![]() ,下列叙述正确的是
,下列叙述正确的是
A.X 的单质着火时可用 CO2 扑灭
B.简单氢化物的稳定性:Y>Z>W
C.W 的氧化物对应的水化物均为强酸
D.YW3 和 Z2W2 中各原子最外层均满足 8 电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烷是一种重要的化工原料,可用作制冷剂、燃料、制备乙烯的原料。请回答下列问题:
(1)已知:①C2H6 (g)![]() C2H4 (g)+H2(g)ΔH1 =+136.8kJ/mol
C2H4 (g)+H2(g)ΔH1 =+136.8kJ/mol
②H2 (g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH2=-285.8 kJ/mol
H2O(l) ΔH2=-285.8 kJ/mol
③ C2H4(g)+3O2(g)![]() 2CO2(g)+2H2O(l); ΔH3= -1411.0 kJ/mol
2CO2(g)+2H2O(l); ΔH3= -1411.0 kJ/mol
则表征 C2H6 (g)燃烧热的热化学方程式为_____。
(2)1000℃时,在某刚性容器内充入一定量的 C2H6 ,只发生反应①,已知平衡时容器中总压为2.1×105Pa,乙 烷的平衡转化率为 40%。
①乙烷分解前容器压强为_____Pa ,1000℃时,反应①的平衡常数 Kp=_____Pa[气体分压(P 分)=气体 总压(Pa)×物质的量分数]。
②若其他条件不变,刚性容器改为体积可变的密闭容器,则达到平衡时乙烷的转化率_____40%(填“>”、“<” 或“=”)。
(3)乙烷催化氧化裂解法是一种新型的制备乙烯的方法:C2H6 (g)+![]() O2(g)
O2(g)![]() C2H4 (g)+H2O(g)ΔH =-149 kJ/mol,
C2H4 (g)+H2O(g)ΔH =-149 kJ/mol,
① 反应 C2H6 (g)+![]() O2(g)
O2(g)![]() C2H4 (g)+H2O(g)ΔH =-149 kJ/mol的正活化能和逆活化能中较大的是________。
C2H4 (g)+H2O(g)ΔH =-149 kJ/mol的正活化能和逆活化能中较大的是________。
② 800℃时,控制原料气的总物质的量一定,当 C2H6 和 O2 的物质的量之比为 2:1 时,乙烯的平衡产率最大,而当![]() 较小时,乙烯的平衡产率较低,可能的原因为_____。
较小时,乙烯的平衡产率较低,可能的原因为_____。
(4)利用电解法可将 C2H6 转化为多种燃料,原理如图所示。铜电极为_____极,该电极上生成 HCOOH 的电极反 应式为_____。
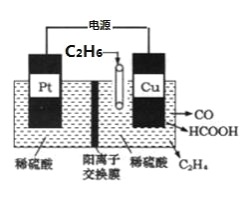
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为解决“温室效应”日趋严重的问题,科学家们不断探索CO2的捕获与资源化处理方案,利用CH4捕获CO2并转化为CO和H2混合燃料的研究成果已经“浮出水面”。
已知:①CH4(g)十H2O(g)=CO(g)+3H2(g) △H1=+206.4kJ/mol
②CO(g)+H2O(g)=CO2(g)+H2(g) △H2=-41.2kJ/mol
T1℃时,在2L恒容密闭容器中加入2molCH4和1molCO2,并测得该研究成果实验数据如下:
时间/s | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
CO2/mol | 1 | 0.7 | 0.6 | 0.54 | 0.5 | 0.5 | 0.5 |
H2/mol | 0 | 0.6 | 0.8 | 0.92 | 1 | 1 | 1 |
请回答下列问题:
(1)该研究成果的热化学方程式③CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=__。
(2)30s时CH4的转化率为__,20~40s,v(H2)=__。
(3)T2℃时,该反应的化学平衡常数为1.5,则T2__T1(填“>”“=”或“<”。)
(4)T1℃时反应③达到平衡的标志为__。
A.容器内气体密度不变
B.体系压强恒定
C.CO和H2的体积分数相等且保持不变
D.2v(CO)逆=v(CH4)正
(5)上述反应③达到平衡后,其他条件不变,在70s时再加入2molCH4和1molCO2,此刻平衡的移动方向为__(填“不移动”“正向
(6)由图可知反应在t1、t2、t3时都达到了平衡,而在t2、t4、t8时都改变了条件,试判断t2时改变的条件可能是__。若t4时降低温度,t5时达到平衡,t6时增大了反应物浓度,请补t4~t6时逆反应速率与时间的关系曲线___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 的3d轨道上有5个电子,试回答:
的3d轨道上有5个电子,试回答:
(1)M元素原子的核外电子排布式为________
(2)M元素原子的最外层电子数为______,价层电子数为______
(3)M元素在元素周期表中的位置为______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com