
【题目】常温下,用0.1 mol·L-1NaOH溶液滴定20 mL 0.1 mol·L-1CH3COOH溶液的滴定曲线如图所示。下列说法正确的是

A. 点①所示溶液中:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)
B. 点②所示溶液中:c(Na+)+c(H+)=c(CH3COO-) +c(CH3COOH) +c(OH-)
C. 点③所示溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D. 在整个滴定过程中:溶液中![]() 始终不变
始终不变
【答案】D
【解析】
A.根据图像可知点①所示溶液中含有等浓度的醋酸钠和醋酸,溶液显酸性,说明醋酸的电离程度大于醋酸根的水解程度,则c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-),A错误;
B.点②所示溶液显中性,则根据电荷守恒可知c(Na+)+c(H+)=c(CH3COO-) +c(OH-),B错误;
C.点③所示溶液中二者恰好反应,生成的醋酸钠水解,溶液显碱性,则c(Na+)>c(CH3COO-)>c(OH-)>c(H+),C错误;
D.![]() 表示醋酸电离平衡常数的倒数,平衡常数只与温度有关系,因此在整个滴定过程中:溶液中
表示醋酸电离平衡常数的倒数,平衡常数只与温度有关系,因此在整个滴定过程中:溶液中![]() 始终不变,D正确。
始终不变,D正确。
答案选D。


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】研究表明,地球上的碳循环,光合作用是必不可少的(如下图所示)。下列叙述正确的是

A. 石油与煤是可再生能源
B. CO2是煤、石油形成淀粉、纤维素等的催化剂
C. 光合作用将太阳能转化为化学能
D. 图中所出现的物质中淀粉与纤维素为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列说法正确的是
A.25°C时,pH=13的氢氧化钡溶液中含有OH-0.1NA个
B.电解精炼铜时,当电路中转移NA个电子,阳极的质量一定减轻了32g
C.0.1 mol H2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2NA
D.1 L 0.1 mol·L-1 NH4Cl溶液中,NH4+的数量为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某种光电池中,当光照在表面涂有氯化银的银片上时,发生反应:AgCl(s)![]() Ag(s)+Cl(AgCl)[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着发生反应:Cl(AgCl)+e-=Cl-(aq)+AgCl(s)。如图为用该光电池电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图,下列叙述正确的是( )
Ag(s)+Cl(AgCl)[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着发生反应:Cl(AgCl)+e-=Cl-(aq)+AgCl(s)。如图为用该光电池电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图,下列叙述正确的是( )

A.光电池工作时,Ag极为电流流出极,发生氧化反应
B.制氢装置溶液中K+移向A极
C.光电池工作时,Ag电极发生的反应为2Cl--2e-=Cl2↑
D.制氢装置工作时,A极的电极反应式为CO(NH2)2+8OH-6e-=CO32-+6H2O+N2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO是大气污染气体,可利用化学反应进行治理或转化。
(1)甲醇是重要的溶剂和燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H<0
CH3OH(g) △H<0
①T℃时,向容积为2L的恒容密闭容器中充入1 mol CO和1.2 mol H2,一段时间后达到平衡,此时H2与CH3OH的体积分数之比为2:5,该反应的平衡常数K=___________;此时若向容器中再通入0.4 mol CO和0.2 mol CH3OH(g),则平衡将___________移动。(填“向正反应方向”“不”或“向逆反应方向”)
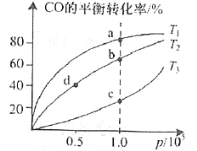
②在一容积可变的密闭容器中充入一定物质的量的CO和H2,测得CO在不同温度下的平衡转化率与压强的关系如图所示。a、b、c三点平衡常数K(a)、K(b)、K(c)的大小关系是___________。b、d点的正反应速率vb(CO)_______va(CO).
(2)沥青混凝土可作为2CO(g)+O2(g)![]() 2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、反应相同的时间,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、反应相同的时间,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
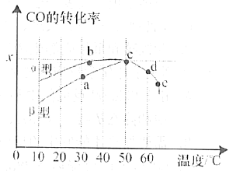
①a、b、c、d四点中表示平衡状态的是___________;
②e点转化率出现突变的原因可能是______________________。
(3)电解法转化CO2可实现CO2资源化利用。电解时CO2在阴极区转化为HCOOH,其原理示意图如下:
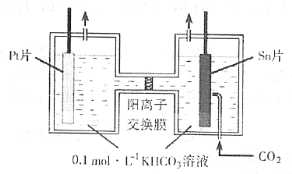
电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
A.图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B.图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b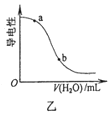
C.图丙表示催化剂能改变化学反应的焓变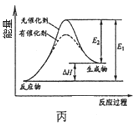
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)![]() N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0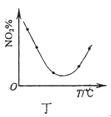
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M是有机合成的重要中间体,制备M的一种合成路线如下(部分反应条件和试剂略去):

已知:①A的密度是相同条件下H2密度的38倍;其分子的核磁共振氢谱中有3组峰;
② (-NH2容易被氧化);
(-NH2容易被氧化);
③ R-CH2COOH
R-CH2COOH
请回答下列问题:
(1)B的化学名称为______。A中官能团的电子式为______。
(2)C![]() D的反应类型是______,I的结构简式为______。
D的反应类型是______,I的结构简式为______。
(3)F![]() G的化学方程式为______。
G的化学方程式为______。
(4)M不可能发生的反应为______(填选项字母)。
a.加成反应 b.氧化反应 c.取代反应 d.消去反应
(5)请写出任意两种满足下列条件的E的同分异构体有______。
①能与FeCl3溶液发生显色反应 ②能与NaHCO3反应 ③含有-NH2
(6)参照上述合成路线,以![]() 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备![]() 的合成路线:______。
的合成路线:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池可净化废水,同时还能获得能源或有价值的化学产品,图1为其工作原理,图2为废水中Cr2O72-离子浓度与去除率的关系。下列说法正确的是

A. M为电池正极,CH3COOH被还原
B. 外电路转移4mol电子时,M 极产生22.4LCO2
C. 反应一段时间后,N极附近的溶液pH下降
D. Cr2O72-离子浓度较大时,可能会造成还原菌失活
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法,正确的是( )
A.图1中,插入海水中的铁棒,越靠近底端腐蚀越严重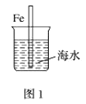
B.图2中,插入溶液中的铁棒容易溶解,主要是发生电化学腐蚀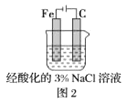
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生电化学腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的负极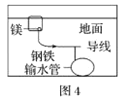
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com