
分析图中的能量变化情况,下列表示方法中正确的是( )
| A.2A+B=2C ΔH<0 |
| B.2C=2A+B ΔH<0 |
| C.2A(g)+B(g)=2C(g) ΔH>0 |
| D.2A(g)+B(g)=2C(g) ΔH<0 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:单选题
某反应过程中能量变化如下图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是
| A.催化剂能降低反应的活化能 |
| B.催化剂能改变反应的焓变(△H) |
| C.该反应为放热反应 |
| D.正反应的活化能小于逆反应的活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是 (填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250 ℃ | 300 ℃ | 350 ℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
反应A(g)+B(g)—→C(g) ΔH,分两步进行:①A(g)+B(g)—→X(g) ΔH1;②X(g)—→C(g) ΔH2。反应过程中能量变化如图所示,E1表示A+B—→X的活化能,下列说法正确的是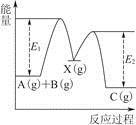
| A.ΔH1=ΔH-ΔH2>0 |
| B.X是反应A(g)+B(g)—→C(g)的催化剂 |
| C.E2是反应②的活化能 |
| D.ΔH=E1-E2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%。下列热化学方程式正确的是
A.2SO3(g)  2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1 2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1 |
B.2SO2(g)+O2(g)  SO3(g)ΔH=-98.3 kJ·mol-1 SO3(g)ΔH=-98.3 kJ·mol-1 |
C.SO2(g)+ O2(g) O2(g) SO3(g)ΔH=+98.3 kJ·mol-1 SO3(g)ΔH=+98.3 kJ·mol-1 |
D.SO2(g)+ O2(g) O2(g) SO3(g)ΔH=-196.6 kJ·mol-1 SO3(g)ΔH=-196.6 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
火电厂利用燃煤发电,煤燃烧中的热化学方程式有:
C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
CO(g)+ O2(g)=CO2(g)ΔH2=-283 kJ/mol
O2(g)=CO2(g)ΔH2=-283 kJ/mol
C(s)+ O2(g)=CO(g)ΔH3=?
O2(g)=CO(g)ΔH3=?
下列有关说法中不正确的是( )
| A.CO的燃烧热为283 kJ/mol |
| B.二氧化碳分解为一氧化碳和氧气的反应是吸热反应 |
| C.ΔH3=ΔH2-ΔH1=110.5 kJ/mol |
| D.ΔH3=ΔH1-ΔH2=-110.5 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
通常人们把拆开1 mol某化学键所吸收的能量或形成1 mol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热(ΔH),已知
| 化学健 | H-H | Cl-Cl | H-Cl |
| 键能 | 436 kJ·mol-1 | 243 kJ·mol-1 | 431 kJ·mol-1 |
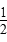 H2(g)+
H2(g)+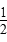 Cl2(g)=HCl(g)ΔH=-91.5 kJ·mol-1
Cl2(g)=HCl(g)ΔH=-91.5 kJ·mol-1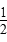 H2(g)+
H2(g)+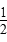 Cl2(g)=HCl(g)ΔH=91.5 kJ·mol-1
Cl2(g)=HCl(g)ΔH=91.5 kJ·mol-1查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列热化学方程式中的反应热下划线处表示燃烧热的是( )
A.NH3(g)+O2(g)  NO(g)+H2O(g) ΔH="-a" kJ·mol-1 NO(g)+H2O(g) ΔH="-a" kJ·mol-1 |
B.C6H12O6(s)+6O2(g) 6CO2(g)+6H2O(l) ΔH="-b" kJ·mol-1 6CO2(g)+6H2O(l) ΔH="-b" kJ·mol-1 |
C.2CO(g)+O2(g) 2CO2(g) ΔH="-c" kJ·mol-1 2CO2(g) ΔH="-c" kJ·mol-1 |
D.CH3CH2OH(l)+O2(g) CH3CHO(l)+H2O(l) ΔH="-d" kJ·mol-1 CH3CHO(l)+H2O(l) ΔH="-d" kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com