
【题目】某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。请回答下列问题:

(1)甲池为__________(填“原电池”、“电解池”或“电镀池”),A电极的电极反应式为___________________________。
(2)丙池中F电极为_________(填“正极”、“负极”、“阴极”或“阳极”),F电极的电极反应式为_________________________________。该池总反应的化学方程式为___________________________。
(3)当乙池中C极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为_____mL(标准状况)。
(4)一段时间后,断开电键K,下列物质能使丙池恢复到反应前浓度的是___(填选项字母)。
A.Cu B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3
【答案】原电池 CH3OH - 6e-+ 8OH- = CO32-+ 6H2O 阴极 Cu2+ + 2e- = Cu 2CuSO4 + 2H2O![]() 2Cu +O2↑+2H2SO4 560 B
2Cu +O2↑+2H2SO4 560 B
【解析】
甲、乙、丙三池中只有甲池中的氧化还原反应能自发进行,因此甲池为原电池,乙、丙为电解池,甲池中通入甲醇的一极A为负极,通入氧气的一极B为正极,乙、丙为串联关系,则电极D、F为阴极,C、E为阳极。
(1)甲池能自发进行氧化还原反应为原电池,通入甲醇的一极A为负极,负极上甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH3OH - 6e-+ 8OH-=CO32-+6H2O,故答案为:CH3OH - 6e-+ 8OH- = CO32-+ 6H2O;
(2)丙池中F电极与甲池负极相连,为电解池的阴极,阴极上Cu2+放电生成Cu,电极反应式为Cu2+ + 2e- = Cu;丙池为电解硫酸铜溶液,电解生成铜、氧气和硫酸,总反应的化学方程式为2CuSO4 + 2H2O![]() 2Cu +O2↑+2H2SO4,故答案为:Cu2++ 2e-= Cu;2CuSO4 + 2H2O
2Cu +O2↑+2H2SO4,故答案为:Cu2++ 2e-= Cu;2CuSO4 + 2H2O![]() 2Cu+O2↑+2H2SO4;
2Cu+O2↑+2H2SO4;
(3)(3)C极上的电极反应为:Ag-e-═Ag+,B电极上的电极反应为:O2+2H2O+4e-═4OH-,当池中C极质量减轻10.8g时,即转移电子是0.1mol,此时甲池中B电极理论上消耗O2的物质的量是0.025mol,体积为0.025mol×22.4L/mol=0.56L=560mL,故答案为:560;
(4)从丙池的电解总反应式可以看出,溶液中减少的“2Cu+O2”相当于CuO,因此可以加入CuO,故答案为:B。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】镁一空气电池的工作原理如图所示,电池反应方程式为:2Mg+O2+2H2O=2Mg(OH)2。有关该电池的说法正确的是( )
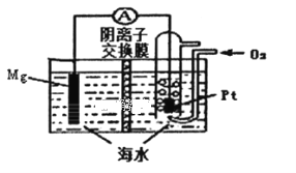
A. 通入氧气的电极为负极
B. 电池工作时,溶液中的Na+由负极移向正极
C. 负极的电极反应为Mg-2e-+2OH-=Mg(OH)2
D. 当电路中转移0.04 mol电子时,参加反应的O2为体积224ml
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示实验室某浓盐酸试剂瓶上的标签,试根据标签上的有关数据回答下列问题:

(1)该浓盐酸的物质的量浓度为___mol·L-1。
(2)取用任意体积的该浓盐酸时,下列物理量中不随所取体积的多少而变化的是__(填字母代号)。
A.溶液中HCl的物质的量 B.溶液的浓度 C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制480mL物质的量浓度为0.400mol·L-1的稀盐酸。
①该学生需要量取__mL(保留一位小数)上述浓盐酸进行配制。如果实验室有5mL、10mL、20mL量筒,应选用__mL量筒最好。若量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将___(偏高、偏低、无影响)。
②配制时所需仪器除了量筒外,还需要的仪器有:___。
③下列情况会导致所配溶液的浓度偏低的是__(填字母代号)。
A.浓盐酸挥发,浓度不足 B.配制前容量瓶中有少量的水
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行反应:2SO2(g)+O2(g) ![]() 2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4mol/L、0.2mol/L、0.4mol/L,当反应达平衡时,可能存在的数据是
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4mol/L、0.2mol/L、0.4mol/L,当反应达平衡时,可能存在的数据是
A. SO2为0.8mol/L,O2为0.4mol/L
B. SO2为0.5mol/L
C. SO3为0.8mol/L
D. SO2、SO3一定均为0.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一块已知质量的铝镁合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
实验方案①:铝镁合金![]() 测定生成的气体在标准状况下的体积
测定生成的气体在标准状况下的体积
实验方案②:铝镁合金![]() 测定生成的气体在标准状况下的体积
测定生成的气体在标准状况下的体积
实验方案③:铝镁合金![]() 溶液
溶液![]() 过滤、洗涤、干燥后测定得到沉淀的质量
过滤、洗涤、干燥后测定得到沉淀的质量
对能否测定出镁的质量分数的实验方案判断正确的是( )
A. 都能B. 都不能C. ①不能,其它都能D. ②③不能,①能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分离提纯的方法不正确的是( )
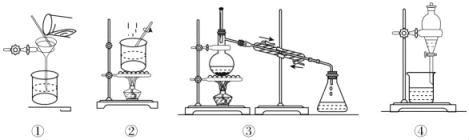
A. 提纯工业乙醇(含甲醇、水等杂质)的装置:③
B. 提纯粗苯甲酸选择装置:②①
C. 提纯粗苯甲酸三个步骤:加热溶解、趁热过滤、冷却结晶
D. 苯中混有少量苯酚选择装置:④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液W中,可能含有K+、Na+、Mg2+、Al3+、Cu2+、NH4+、OH、Cl、CO32-、AlO2-、SiO32-中的一种或几种,其所含的阴离子的物质的量浓度相等,取一定量该溶液,向其中加入一定物质的量浓度的稀盐酸,产生沉淀的物质的量(n)与加入盐酸的体积(V)的关系如图所示,下列有关说法不正确的是
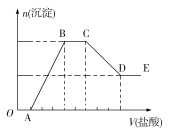
A. 该溶液中至少含有5种离子(不考虑水的电离)
B. B→C分为两个反应阶段,有两个离子反应,且反应过程中有气体生成
C. A点与D点含有同一种元素的离子能反应生成B、C两点含同一种元素的物质
D. 向W溶液中通入B→C产生的气体至过量,产生的沉淀与B点产生的沉淀不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜与稀硝酸反应制备NO是化学实验教学中的重要实验之一,但是由于反应进度不易控制、NO易被氧化以及容易造成空气污染等原因在教学实践中不易操作,如图为该实验进行改进示意图。回答下列问题:

(1)组装实验装置并检验装置的气密性,检验气密性的方法为___。
(2)如果该装置气密性良好,如图装好药品,并能保证B中的两根玻璃导管能穿过塑料隔板,然后在塑料隔板上添加铜片,在反应发生前需要进行的必要操作为:打开试管C上部的止水夹,从A口通入__气体,当__时,停止从A口通气体,并用止水夹夹住A口的橡胶管。
(3)引发Cu与稀HNO3反应发生的操作:__。
(4)B中的实验现象:___。
(5)简述使实验停止的操作:___。
(6)实现无色气体迅速变为红棕色的操作:____。
(7)澄清石灰水和蘸有NaOH溶液的棉花团都可以吸收尾气,若NaOH溶液吸收NO和NO2混合气体后无气体剩余,请写出发生反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下十种物质:①稀H2SO4②纯醋酸(CH3COOH)③NaOH溶液④FeCl3固体⑤CaCO3固体⑥CO2⑦熔融NaHSO4⑧Ba(HCO3)2溶液⑨乙醇(C2H5OH)⑩NH3H2O请回答下列问题
(1)其中能导电的是______;其中属于非电解质的是______;属于弱电解质的是______。(填序号)
(2)将题中④物质溶于水配成饱和溶液,滴入沸水中,继续煮沸至出现红褐色可制得Fe(OH)3胶体,写出该过程的化学方程式______。
(3)按要求写出题中各物质发生反应的离子方程式
①与⑧反应______;
②的水溶液与⑤的反应______;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com