ʵ���ϵ���ƽ�⡢�ε�ˮ��ƽ�������ܽ�ƽ��ȣ����Ƕ��ɿ����ǻ�ѧƽ���һ�֣��������ѧ��ѧ֪ʶ�ش��������⣺
��1����ҵ��һ��ɲ������·�Ӧ���ϳɼ״���CO��g��+2H
2��g��?CH
3OH��g��
�����÷�Ӧ���ش��������⣺
��ƽ�ⳣ������ʽΪK=
��
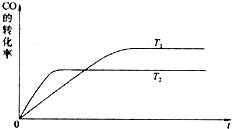
����ͼ�Ǹ÷�Ӧ�ڲ�ͬ�¶���CO��ת������ʱ��仯�����ߣ�
T
1��T
2�¶��µ�ƽ�ⳣ����С��ϵ��K
1
K
2�����������������=������
����֪�ڳ��³�ѹ�£�2CH
3OH��l��+3O
2��g��=2CO
2��g��+4H
2O��g����H=-akJ?mol
-1��2CO��g��+O
2��g��=2CO
2��g����H=-bkJ?mol
-1��H
2O��g��=H
2O��l����H=-ckJ?mol
-1����CH
3OH��l��+O
2��g��=CO��g��+2H
2O��l����H
kJ?mol
-1��
��2�������£����ȡ0.1mol?L
-1HA��Һ��0.1mol?L
-1NaOH��Һ�������ϣ����ƻ�Ϻ���Һ����ı仯������û����Һ��pH=8����ش��������⣺
�ٻ�Ϻ���Һ��pH=8��ԭ�������ӷ���ʽ��ʾ����
��
�ڻ����Һ��c��Na
+��-c��A
-��=
mol?L
-1���ȷ�������ľ������֣���
����֪NH
4A��ҺΪ���ԡ���HA��Һ�ӵ�Na
2CO
3��Һ��������ų������ƶ�NH
4HCO
3��Һ��pH
7���������=��
��AgCl����Һ�д�������ƽ��AgCl��s��?Ag
+��aq��+Cl
-��aq������25��ʱ��AgCl��K
sp=1.8��10
-10���ֽ�����AgCl�ֱ��������Һ���У�a.100mL����ˮb.100mL 0.3mol?L
-1AgNO
3��Һc.100mL0.1mol?L
-1MgCl
2��Һ��ֽ������ȴ����ͬ�¶ȣ���Һ��c��Ag
+���ɴ�С��˳��Ϊ
������ţ���




