
【题目】丙烯酰胺(H2C=CH—CONH2)具有中等毒性,它对人体可造成神经毒性和遗传毒性。丙烯酰胺主要是由高碳水化合物、低蛋白质的植物性食物在加热(120℃以上)烹调过程中形成,特别在烘烤、油炸时更易形成。丙烯酰胺可以进一步形成在工业上有用的聚丙烯酰胺类物质。

回答下列问题:
(1)D的结构简式为___,F的结构简式为___。
(2)指明下列反应类型:A→B___,C→D___。
(3)丙烯酰胺有多种同分异构体,写出分子中同时含有醛基和碳碳双键的同分异构体:___。
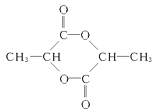
(4)写出D→E的化学方程式:__。2分子C在浓硫酸作用下可形成一个六元酯环,该反应的化学方程式为___。
【答案】H2C=CH—COOH 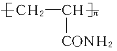 水解反应 消去反应 H2C=CH—NH—CHO、H2C=C(NH2)—CHO、H2N—HC=CH—CHO H2C=CH—COOH+NH3→H2C=CH—CONH2+H2O 2CH3—CH(OH)—COOH
水解反应 消去反应 H2C=CH—NH—CHO、H2C=C(NH2)—CHO、H2N—HC=CH—CHO H2C=CH—COOH+NH3→H2C=CH—CONH2+H2O 2CH3—CH(OH)—COOH![]()
 +2H2O
+2H2O
【解析】
A发生水解反应生成B,由A、B的分子组成可知,B为葡萄糖,B一定条件下反应生成C,C在浓硫酸、加热条件下反应生成D,D与氨气反应生成E,E通过加聚反应生成聚丙烯酸酰胺F,则E是丙烯酸酰胺H2C=CH-CONH2,结合C的分子式逆推,C为CH3CH(OH)COOH,D为CH2=CH-COOH,F为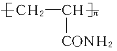 ,2分子的CH3CH(OH)COOH在浓硫酸作用下可形成一个六元酯环,该化合物为
,2分子的CH3CH(OH)COOH在浓硫酸作用下可形成一个六元酯环,该化合物为 ,据此解答。
,据此解答。
(1)根据上述分析可知,D的结构简式为CH2=CH-COOH,F的结构简式为![]() ;
;
(2)(C6H10O5)n→C6H12O6发生水解反应;CH3CH(OH)COOH→CH2=CH-COOH发生消去反应;
(3)丙烯酰胺的同分异构体,同时含有醛基和碳碳双键,符合条件的是H2C=CH—NH—CHO、H2C=C(NH2)—CHO、H2N—HC=CH—CHO;
(4)CH2=CH-COOH与氨气反应生成H2C=CH-CONH2和水,化学方程式是:H2C=CH—COOH+NH3→H2C=CH—CONH2+H2O;2分子的CH3CH(OH)COOH在浓硫酸作用下可形成一个六元酯环,该化合物为 ,反应的化学方程式为2CH3—CH(OH)—COOH
,反应的化学方程式为2CH3—CH(OH)—COOH![]()
 +2H2O。
+2H2O。


科目:高中化学 来源: 题型:
【题目】聚对苯二甲酸乙二醇酯(PET)俗称涤纶,是一种重要的有机高分子材料。其结构为![]() 。其合成路线如图:
。其合成路线如图:
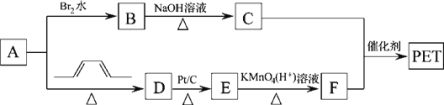
已知:![]()

回答下列问题:
(1)B的名称是__,C中官能团的电子式为__。
(2)A→D的反应类型为___。
(3)E的结构简式为___。
(4)写出C+F→PET的化学反应方程式__。
(5)G是F的同系物,其相对分子质量比F多14,则符合该条件的G的结构共有__种,写出其中苯环上只有一个取代基的结构简式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
(1)将准确称取的4.3g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有___、___。
(2)取10.00mL待测液,用___滴定管量取。
(3)用0.2010mol/L标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视___,直到滴定到终点。
(4)根据下列数据,c(NaOH)=___,烧碱的纯度为___。
滴定次数 | 待测液体积 (mL) | 标准盐酸的体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
(5)以标准盐酸溶液滴定未知的氢氧化钠溶液为例,判断下列操作引起的误差(填偏大、偏小、无影响)
①读数:滴定前平视,滴定后俯视___。
②未用标准液润洗滴定管___。
③用待测液润洗锥形瓶___。
④不小心将标准液滴在锥形瓶外面___。
⑤滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.放热反应都不需要加热就能发生
B.同温同压下,H2 (g) +Cl2(g) =2HCl (g)在光照和点燃条件下放出的能量不同
C.保持其它条件不变,增加反应物的量或增大压强,反应速率就会随之改变
D.使用催化剂会加快反应速率是因为催化剂降低了反应物的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在周期表中的位置_____,![]() Mc 的中子数为_____。已知存在P(S,红磷)、P(S,黑磷) 、P(S,白磷),它们互称为_____。
Mc 的中子数为_____。已知存在P(S,红磷)、P(S,黑磷) 、P(S,白磷),它们互称为_____。
(2)热稳定性:NH3_____PH3(填“>”或“<”),砷的最高价氧化物对应水化物的化学式为_____是一种_____酸(填“强”或“弱”) 。
(3)PH3 和卤化氢反应与 NH3 相似,产物的结构和性质也相似。写出 PH3 和 HI 反应的化学方程式_____。
(4)SbCl3 能发生较强烈的水解,生成难溶的 SbOCl,写出该反应的化学方程式_____,因此,配制 SbCl3溶液时应注意_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中,错误的是 ( )
A.配制 5%食盐溶液时,称量 5g 食盐放入烧杯中加入 95g 水搅拌溶解
B.胆矾晶体结晶水含量测定时,需用小火缓慢加热,防止晶体飞溅
C.测定未知 NaOH 溶液浓度时,红色手柄滴定管需用标准酸液润洗 2﹣3 次
D.配制 0.1 mol/L 的 H2SO4 溶液时,将量取的浓 H2SO4 放入容量瓶中加水稀释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组设计以下实验方案,测定某含有NaCl的小苏打样品中![]() 的质量分数。
的质量分数。
(方案一)查资料:NaCl加热至![]() 时熔化而不分解,
时熔化而不分解,![]() 受热分解,
受热分解,![]() 。由此设计实验:用电子天平称取
。由此设计实验:用电子天平称取![]() 样品,置于坩埚中用酒精灯加热(如图,灼烧温度高于
样品,置于坩埚中用酒精灯加热(如图,灼烧温度高于![]() ,不超过
,不超过![]() ),至恒重后,冷却,称量剩余固体质量为
),至恒重后,冷却,称量剩余固体质量为![]() 。
。
(1)实验中至少称量____次。
(2)实验中,达到恒重操作的标准是__________。
(方案二)根据“![]() 溶液呈碱性,
溶液呈碱性,![]() ”的性质设计实验:准确称取1.000 g样品,用容量瓶配成100 mL溶液,用滴定管量取20.00 mL于锥形瓶中,加入2滴甲基橙为指示剂,用0.1000mol/L盐酸标准溶液滴定。平行两份,两次实验的数据如下:
”的性质设计实验:准确称取1.000 g样品,用容量瓶配成100 mL溶液,用滴定管量取20.00 mL于锥形瓶中,加入2滴甲基橙为指示剂,用0.1000mol/L盐酸标准溶液滴定。平行两份,两次实验的数据如下:
1 | 2 | |
| 20.00 | 20.00 |
| 0.00 | 0.20 |
| 19.98 | 20.22 |
(3)实验中,当其它操作均正确时,下列操作不会引起实验误差的是(______)。
A.容量瓶用蒸馏水洗净后,瓶内有水残留,直接配制溶液
B.滴定管内壁有水珠就装入标准液
C.锥形瓶内壁有水珠,用待测液润洗后再使用
D.锥形瓶用蒸馏水洗净后,直接放入待测液进行测定
span>(4)滴定终点的判断:__________。
(5)两次实验消耗盐酸体积的平均值为__________mL。
(6)样品中![]() 的质量分数__________。
的质量分数__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 分解速率受多种因素影响。实验测得
分解速率受多种因素影响。实验测得![]() 时不同条件下
时不同条件下![]() 浓度随时间的变化如图所示
浓度随时间的变化如图所示![]() 起始浓度均为
起始浓度均为![]() 。下列说法正确的是
。下列说法正确的是![]()
![]()
实验条件 |
|
|
|
① | 0 | 0 | |
② |
| 0 | |
③ |
| 3 | |
④ |
| 3 |
A.![]() 内,④条件下
内,④条件下![]() 的平均反应速率为
的平均反应速率为![]()
B.分析②③条件可知,![]() 浓度越大,
浓度越大,![]() 分解速率越慢
分解速率越慢
C.少量![]() 存在时,溶液碱性越强,
存在时,溶液碱性越强,![]() 分解速率越快
分解速率越快
D.分析①②条件可知,无![]() 时,碱性条件有利于双氧水的分解
时,碱性条件有利于双氧水的分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将0.1mol下列物质分别投入90g水中充分混合:①Na②NaOH③Na2O④Na2O2,所得溶液中OH-物质的量浓度大小排列顺序正确的是( )
A.③>④>②>①B.④>③>②>①
C.①>④=③>②D.③=④>①>②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com