
| A. |  | B. |  | ||
| C. | 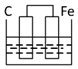 | D. | 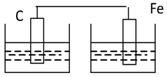 |
分析 根据原电池的构成条件判断,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应.
解答 解:A.锌比铁活泼,二者接触,并插入电解质溶液中,锌失电子,溶液中氢离子在铁电极上得电子,能构成原电池,故A不选;
B.铁比铜活泼,二者接触,并插入电解质溶液中,铁失电子,溶液中氢离子在铜电极上得电子,能构成原电池,故B不选;
C.铁比碳活泼,二者接触,并插入电解质溶液中,铁失电子,溶液中氢离子在碳电极上得电子,能构成原电池,故C不选;
D.D没有构成闭合回路,所以不能构成原电池,故D选;
故选D.
点评 本题考查了原电池的构成条件,难度不大,原电池的四个条件必须同时具备,缺一不可,否则不能构成原电池.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
 反应类型加聚反应
反应类型加聚反应 反应类型取代反应
反应类型取代反应 反应类型取代反应
反应类型取代反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都能使溶液的pH增大 | |
| B. | 都能使溶液中c(H+)•c(CH3COO-)减小 | |
| C. | 都能使溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$比值增大 | |
| D. | 溶液中$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOK(固体) | B. | CH3COOH | C. | KCl(固体) | D. | KOH(固体) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
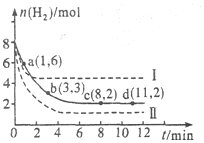 工业上有一种用C02来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).图中数据a(1,6)表示:在1min时H2的物质的量是6mol.
工业上有一种用C02来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).图中数据a(1,6)表示:在1min时H2的物质的量是6mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
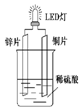 以Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,供LED发光,装置如图所示.
以Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,供LED发光,装置如图所示.
| 序号 | 甲 | 乙 | 丙 |
| 装置 |  | 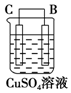 |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应: CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ CH=CH2(g)+H2(g)工业上通常在乙苯蒸气中掺混水蒸气来保持体系总压为常压的条件下进行反应,利用热力学数据计算得到温度和投料比M对乙苯平衡转化率的影响可用下图表示:已知M=$\frac{m({H}_{2}O)}{n(乙苯)}$,下列说法正确的是( )
CH=CH2(g)+H2(g)工业上通常在乙苯蒸气中掺混水蒸气来保持体系总压为常压的条件下进行反应,利用热力学数据计算得到温度和投料比M对乙苯平衡转化率的影响可用下图表示:已知M=$\frac{m({H}_{2}O)}{n(乙苯)}$,下列说法正确的是( )| A. | 若不改变温度,减小压强使乙苯转化率和反应速率都减小 | |||||||||||
| B. | 已知
| |||||||||||
| C. | A、B两点对应的平衡常数大小:KA<KB | |||||||||||
| D. | 投料比的大小顺序:M1<M2<M3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com