
| A. | CH3COOK(固体) | B. | CH3COOH | C. | KCl(固体) | D. | KOH(固体) |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 从环境保护角度,氟氯代烷不宜用作制冷剂 | |
| B. | 聚氯乙烯制品适宜用于直接盛装食物 | |
| C. | 苯、甲苯、二甲苯都是基本的有机化工原料 | |
| D. | 乙烯用作果实催熟剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述两个反应中,水既不是氧化剂也不是还原剂 | |
| B. | 上述两个反应中,氧化产物都是H3PO4 | |
| C. | 反应(2)中,1mol CuSO4可氧化1/5molP | |
| D. | 上述两个反应中,氧化剂都只有硫酸铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2C2O4 | H2S |
| 电离平衡常数 | 1.8×10-5 | Ka1=5.4×10-2 Ka2=5.4×10-5 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
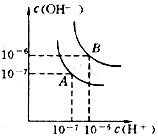 水的电离平衡线如图所示.若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点
水的电离平衡线如图所示.若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中硫酸做还原剂,有铜被还原 | |
| B. | NH4CuSO3中硫元素被氧化 | |
| C. | 2mol NH4CuSO3完全反应转移6.02×1023个电子 | |
| D. | 刺激性气味的气体是氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
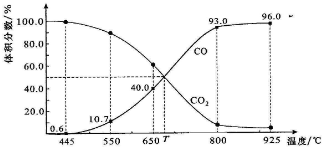
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com