
【题目】在容积一定的密闭容器中,可逆反应:A2(g)+ B2(g)![]() xC(g) 符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是
xC(g) 符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是
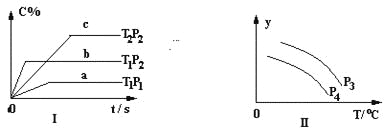
A. P3<P4,Y轴表示A2的转化率
B. P3<P4,Y轴表示A2的浓度
C. P3>P4,Y轴表示混合气体的密度
D. P3>P4,Y轴表示混合气体的平均摩尔质量
【答案】D
【解析】试题解析:由图Ⅰ可知,温度为T1时,根据到达平衡的时间可知P2>P1,且压强越大,C的含量越高,说明平衡向正反应方向移动,正反应为气体体积减小的反应;压强为P2时,根据到达平衡的时间可知T1>T2,且温度越高,C的含量越低,说明平衡向逆反应方向移动,则正反应为放热反应。则:P3<P4,在温度相同条件下,增大压强平衡向正反应移动,A2的转化率增大,同时升高温度平衡向逆反应移动,A2的转化率降低,图象与实际不符,故A错误;P3<P4,在温度相同条件下,增大压强平衡向正反应移动,A2的浓度降低,同时升高温度平衡向逆反应移动,A2的浓度增大,图象与实际不符,故B错误;P3>P4,在温度相同条件下,增大压强平衡向正反应移动,但混合气体的质量不变,容器的体积不变,密度不变.升高温度平衡向逆反应移动,但混合气体的质量不变,容器的体积不变,密度不变,图象与实际不相符,故C错误;P3>P4,在相同温度下增大压强平衡向正反应方向移动,混合气体的总质量不变,总的物质的量减小,混合气的平均摩尔质量增大,升高温度,平衡向逆反应方向移动,混合气体总的物质的量增大,混合气的平均摩尔质量减小,图象与实际相符,故D正确。


科目:高中化学 来源: 题型:
【题目】氢化锂(LiH)属于离子化合物。LiH跟水反应可以放出氢气。下列叙述中正确的是
A.LiH的水溶液显中性B.LiH中的氢离子可以被还原生成氢气
C.LiH是一种强氧化剂D.LiH中氢离子比锂离子的半径大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水仙花所含的挥发油中含有丁香油酚、苯甲醇、苯甲醛、桂皮醇等成分。它们的结构简式如下:
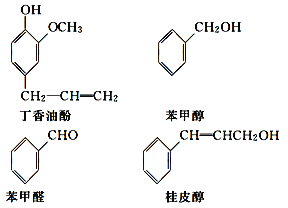
请回答下列问题:
(1)①丁香油酚中含氧的官能团是_____;丁香油酚可能具有的性质是_____(填字母)。
A.可与烧碱反应
B.只能与Br2发生加成反应
C.既可燃烧,也可使酸性KMnO4溶液褪色
D.可与NaHCO3溶液反应放出CO2气体
②从结构上看,上述四种有机物中与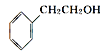 互为同系物的是____(填名称)。
互为同系物的是____(填名称)。
(2)苯甲醛经________(填反应类型)反应可得到苯甲醇。写出苯甲醛和银氨溶液反应化学方程式为___________________________________。
(3)由桂皮醇转化为丙的过程为(已略去无关产物)
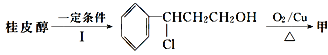
![]() 乙
乙![]() 丙
丙
如果反应Ⅱ为消去反应,则反应Ⅱ的条件是_______________,反应Ⅲ为加聚反应,则高聚物丙的结构简式为 _________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。一种制备草酸钴晶体(CoC2O4·2H2O)的工艺流程如下
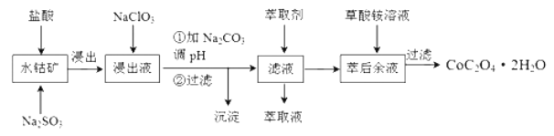
已知:①水钴矿主要成分为Co2O3、Co(OH)3;还含有少量Fe2O3、Al2O3、MnO等杂质。
②浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、A13+等
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(金属离子浓度以0.01mol·L-1计)
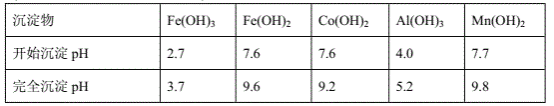
(1)写出浸出过程中Co(OH)3发生反应的离子方程式:______________________________。
(2)NaClO3的作用是_____________________________________________。
(3)加Na2CO3调pH的范围应该在_______________间,a加入萃取剂的目的是______________________________。
(4)在空气中加热5.49g草酸钻晶体(CoC2O4·2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:
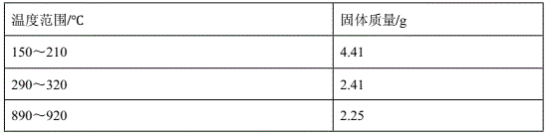
经测定,210~290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是_____________________________________________。[M( CoC2O4·2H2O)=183g/mol]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法正确的是
A. 月饼因为富含油脂而易发生氧化,保存时常放入装有硅胶的透气袋
B. 《抱朴子·金丹篇》中记载:“丹砂烧之成水银,积变又还为丹砂”。该过程发生了氧化还原反应
C. 酸雨样品露天放置段时间,酸性减弱,是由于酸雨所含成分被氧化
D. 含磷污水是很好的肥料,可灌溉庄稼。可直接排放到自然界水体中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一固体粉末,可能由Na2CO3、Na2SO4、CuSO4、NH4Cl中的一种或几种组成,为了检验它们所含的物质,做了以下实验。
①将固体溶于水,搅拌后得到无色透明溶液;②往此溶液中滴加氯化钡溶液,有白色沉淀生成;③过滤,将沉淀置于稀盐酸中,发现沉淀不溶解。
(1)试判断:固体混合物中肯定含有____________________,生成白色沉淀的化学方程式______________________________________;肯定没有_____________________________;可能含有________________________
(2)检验是否含有可能存在的物质的实验方法是:________化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用如图一装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A (A下端活塞关闭)中。
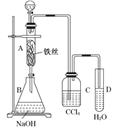
(1)写出A中反应的化学方程式________________。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是________________,写出有关的化学方程式___________________。
(3)C中盛放CCl4的作用是____________________。
(4)若证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入___________,现象是_______________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)现有下列状态的物质:①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸 ⑤FeCl3溶液 ⑥铜 ⑦熔融KOH ⑧盐酸。其中能导电的是__________,(填序号,下同),属于电解质的是___________,属于非电解质的是___________。
(2)将3p%的硫酸与同体积的p%的硫酸混合得到q%的稀硫酸,则p、q的关系是________
(3)在同温、同压下,实验测得CO、N2和SO2三种气体的混合气体的密度是H2的20倍,其中SO2的体积分数为______;若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如下图所示)。下列说法错误的是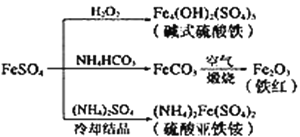
A. 常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
B. 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C. 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D. 碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com