
| A、该反应的氧化剂只有CuSO4 | ||
| B、SO42-既不是氧化产物也不是还原产物 | ||
C、1 mol CuSO4还原了
| ||
| D、被还原的S和被氧化的S的质量比为7:3 |
| 1 |
| 7 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2004全国各省市高考模拟试题汇编·化学 题型:021
对反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,下列结论正确的是
[ ]
A.只有CuSO4作氧化剂
B.FeS2既是氧化剂又是还原剂
C.被氧化的硫和被还原的硫的质量之比为3∶7
D.1mol CuSO4可以氧化5/7mol硫元素
查看答案和解析>>
科目:高中化学 来源:2013-2014学年吉林省白山市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
对反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4的下列说法正确的是
A.该反应的氧化剂只有CuSO4
B.SO42-既不是氧化产物也不是还原产物
C.1 mol CuSO4还原了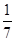 mol的S
mol的S
D.被还原的S和被氧化的S的质量比为7:3
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com