
【题目】以煤为原料可合成一系列燃料。
(1)已知:①2H2(g)+O2(g)= 2H2O(g)△H=-483.6kJ/mol
②CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol
请写出甲醇燃烧生成H2O(g)的热化学方程式_________;
(2)向1L密闭容器中加入2mol CO、4mol H2,在适当的催化剂作用下,发生反应:2CO(g)+4H2(g)![]() CH3OCH3(l)+H2O(l)△H=+71kJ/mol
CH3OCH3(l)+H2O(l)△H=+71kJ/mol
①该反应能否_________自发进行(填“能”、“不能”或“无法判断”)
②下列叙述能说明此反应达到平衡状态的是_________.
a.混合气体的平均相对分子质量保持不变
b.CO和H2的转化率相等
c.CO和H2的体积分数保持不变
d.混合气体的密度保持不变
e.1mol CO生成的同时有1mol O-H键断裂
(3)CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H<0在一定条件下,某反应过程中部分数据如下表:
CH3OH(g)+H2O(g)△H<0在一定条件下,某反应过程中部分数据如下表:
反应条件 | 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
恒温 恒容 (T1℃、 2L) | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 |
①0~10min内,用H2O(g)表示的化学反应速率v(H20)=_________mol/(L·min)
②达到平衡时,该反应的平衡常数K=_________(用分数表示),平衡时H2的转化率是_________。
③在其它条件不变的情况下,若30min时改变温度为T
(4)用甲醚(CH3OCH3)作为燃料电池的原料,请写出在碱性介质中电池负极反应式_________.
【答案】 CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g)△H=﹣676.4kJ/mol
O2(g)=CO2(g)+2H2O(g)△H=﹣676.4kJ/mol
或2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H=﹣1352.8kJ/mol 不能 d 0.025 4/27 50% < 该反应正反应是放热反应,温度升高,平衡逆向移动(答出“放热反应”和“温度升高,平衡逆向移动”各1分) 不 CH3OCH3 — 12e— + 16OH— == 2CO32— + 11H2O
【解析】(1)①2H2(g)+O2(g)= 2H2O(g)△H=-483.6kJ/mol,②CH3OH(g)+H2O(g) =CO2(g)+3H2(g) △H=+49.0kJ/mol,根据盖斯定律,将①×3+②×2得:2CH3OH(g)+3O2(g) =2CO2(g)+4H2O(g)△H=(-483.6kJ/mol)×3+(+49.0kJ/mol)×2=﹣1352.8kJ/mol,故答案为:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H=﹣1352.8kJ/mol;
(2)①2CO(g)+4H2(g)![]() CH3OCH3(l)+H2O(l)△H=+71kJ/mol,该反应的△H>0,△S<0,根据△G=△H-T△S>0,反应不能自发进行,故答案为:不能;
CH3OCH3(l)+H2O(l)△H=+71kJ/mol,该反应的△H>0,△S<0,根据△G=△H-T△S>0,反应不能自发进行,故答案为:不能;
②a.混合气体中CO和H2的组成一直不变,混合气体的平均相对分子质量始终保持不变,不能说明此反应达到平衡状态,错误;b.CO和H2的物质的量之比大于化学计量数之比,转化率始终相等,不能说明此反应达到平衡状态,错误;c.混合气体中CO和H2的组成一直不变,CO和H2的体积分数始终保持不变,不能说明此反应达到平衡状态,错误;d.容器的体积不变,混合气体的质量变化,当混合气体的密度保持不变时,能够说明此反应达到平衡状态,正确;e.1mol CO生成的同时一定有1mol O-H键断裂,不能说明此反应达到平衡状态,错误;故选d;
(3)①v(H2)=![]() =0.075mol/(L·min),速率之比等于化学计量数之比,v(H2O)=
=0.075mol/(L·min),速率之比等于化学计量数之比,v(H2O)=![]() v(H2)=0.025mol/(L·min),故答案为:0.025;
v(H2)=0.025mol/(L·min),故答案为:0.025;
②20min时,转化的CO2为2mol-1mol=1mol,则生成的CH3OH为1mol,而30min时CH3OH为1mol,故20min时到达平衡,
CO2(g)+3H2(g)CH3OH(g)+H2O(g)
开始(mol/L):2 6 0 0
转化(mol/L):1 3 1 1
平衡(mol/L):1 3 1 1
故平衡常数K=![]() =
=![]() =
=![]() ,平衡时氢气的转化率=
,平衡时氢气的转化率=![]() ×100%=50%,故答案为:
×100%=50%,故答案为:![]() ;50%;
;50%;
③在其它条件不变的情况下,若30min时改变温度为T2℃,此时H2的物质的量为3.2mol,说明平衡逆向一定,说明改变的条件是升高温度,则T1<T2, 若30min时只向容器中再充入1molCO2(g)和1molH2O(g),此时浓度商Qc=![]() =
=![]() =K,则平衡不移动,故答案为:<;该反应正反应是放热反应,温度升高,平衡逆向移动;不;
=K,则平衡不移动,故答案为:<;该反应正反应是放热反应,温度升高,平衡逆向移动;不;
(4)用甲醚(CH3OCH3)作为燃料电池的原料,在碱性介质中电池负极上甲醚发生氧化反应生成碳酸根离子,反应式为CH3OCH3 — 12e— + 16OH— == 2CO32— + 11H2O,故答案为CH3/span>OCH3 — 12e— + 16OH— == 2CO32— + 11H2O。


科目:高中化学 来源: 题型:
【题目】草木灰中富含钾盐,主要成分是碳酸钾,还含有少量氯化钾和硫酸钾等。现从某草木灰样品中提取钾盐,并检验其中的![]() 、
、![]() 和Cl。
和Cl。
(1)从草木灰中提取钾盐的实验操作步骤如下,请补充完整:
① ②过滤 ③蒸发浓缩 ④冷却结晶 ⑤过滤。
(2)上述操作中需要用到玻璃棒的是 (填序号)。
(3)将制得的少量晶体加水溶解后,分别置于三支试管中。
①向第一支试管中加入少量稀盐酸,可观察到 ,说明溶液中存在 离子。
②向第二支试管中加入 ,可观察到 ,说明溶液中存在![]() 。
。
③向第三支试管中先加入足量Ba(NO3)2溶液,过滤后,再向滤液中加入足量 溶液,可观察到白色沉淀,说明溶液中存在Cl。其中,加入足量Ba(NO3)2溶液的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是有关厨房中的常见操作或常见现象,其中不属于氧化还原反应的是
A. 烧菜用过的铁锅,经放置常出现红棕色斑迹
B. 用气灶燃烧沼气(主要成分为甲烷)为炒菜提供热量
C. 牛奶久置变质腐败
D. 氧化铜固体加入稀盐酸中,完全溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: B是相对分子质量为28的烃,核磁共振氢谱显示分子中只有一种化学环境的氢原子,A是烃的含氧衍生物。且有如下的转化关系:

(1)A的结构简式是___________________B的结构式是___________________
(2)反应①是D与HCl按物质的量之比1︰1的化合反应,则D的分子式是_________________,D的红外光谱表明分子内除C—H键、C—C键外还含有两个C—O单键.则D的结构简式是___________________。
(3)反应②可表示为:G + NH3 → F + HCl (未配平),该反应配平后的化学方程式是(有机化合物均用结构简式表示):_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 乙酸与乙酸乙酯互为同分异构体 B. 乙烷室温下能与溴水发生取代反应
C. 医用消毒酒精中乙醇的浓度为9.5% D. 乙烯可以用作生产食品包装材料的原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下,同体积的氨气(NH3)和硫化氢(H2S)气体的质量比为________。
(2)同温同压下,氨气和硫化氢气体的密度比为________。
(3)在标准状况下,0.01 mol某气体的质量为0.44 g,则该气体的密度为________g·L1(保留小数点后两位),该气体的相对分子质量为________。
(4)在标准状况下,14 g CO与2 g H2的混合气体体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石油化工产品1,3-丁二烯合成化工中间产品D (![]() )的合成路线如下:
)的合成路线如下:
已知:

(1)物质D中所含官能团名称为_________,一定条件下,1 molD最多与_________molH2发生加成反应。
(2)写出②⑥的反应类型分别是_________、_________。
(3)④反应的化学方程式_________。⑤反应的化学方程式_________。
(4)A 的系统命名是_________。
(5)写出与物质D互为同分异构体且满足以下条件的有机物结构简式_________。
① 能与FeCl3溶液发生显色反应
② 能发生银镜反应
③ 核磁共振氢谱显示有5组峰
(6)请设计合理方案用![]() 合成
合成![]() 。(其他原料自选,用反应流程图表示,并注明必要的反应条件)。_______
。(其他原料自选,用反应流程图表示,并注明必要的反应条件)。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年10月中国药学家屠呦呦因发现青蒿素(一种用于治疗疟疾的药物)而获得诺贝尔生理医学奖。青蒿素(C15H22O5)的结构如图所示。请回答下列问题:

(1)组成青蒿素的三种元素电负性由大到小排序是 ,在基态O原子中,核外存在 对自旋相反的电子。
(2)下列关于青蒿素的说法正确的是 (填序号)。
a.青蒿素中既存在极性键又存在非极性键
b.在青蒿素分子中,所有碳原子均处于同一平面
c.图中数字标识的五个碳原子均只以σ键与其它原子成键
(3)在确定青蒿素结构的过程中,可采用NaBH4作为还原剂,其制备方法为:4NaH + B(OCH3)3 → NaBH4+ 3CH3ONa
① NaH为 晶体,右图是NaH晶胞结构,则NaH晶体的配位数是 ,若晶胞棱长为a则Na原子间最小核间距为 。
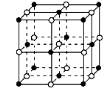
② B(OCH3)3 中B采用的杂化类型是 。写出两个与B(OCH3)3 具有相同空间构型的分子或离子 。
③ NaBH4结构如图所示。结构中存在的作用力有 。
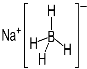
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com