
用下列装置不能达到实验目的的是( )
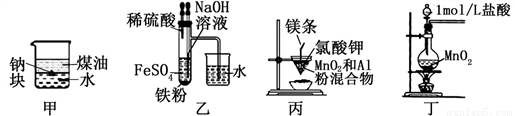
A. 用甲图装置可证明ρ(煤油)< ρ(钠) < ρ(水) B. 用乙图装置制备Fe(OH)2
C. 用丙图装置制取金属锰 D. 用丁图装置制取氯气
科目:高中化学 来源:2016-2017学年北京市怀柔区高一上学期期末考试化学试卷(解析版) 题型:选择题
苹果汁是人们喜爱的饮料。由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有
A.氧化性 B.还原性 C.碱性 D.酸性
查看答案和解析>>
科目:高中化学 来源:湖北省沙市2016-2017学年高二下学期第三次双周考化学试卷(A卷) 题型:选择题
增强铝的耐腐蚀性,现以铅蓄电池以外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使表面表面的氧化膜增厚。反应原理如下:电池:Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O (I)
电解池:2Al+3H2O Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下判断正确的是
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3mol Pb | 生成2mol Al2O3 |
C | 正极:PbO2+4H++2e-═Pb2++2H2O | 阳极:2Al+3H2O-6e-═Al2O3+6H+ |
D |
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:湖北省沙市2016-2017学年高二下学期第三次双周考化学试卷(A卷) 题型:选择题
下列各组物质汽化或熔化时,所克服的微粒间的作用力属同种类型的是( )
A. 二氧化硅和生石灰的熔化 B. 碘和干冰的升华 C. 氯化钠和铁的熔化 D. 食盐和冰的熔化
查看答案和解析>>
科目:高中化学 来源:2017届湖北省、襄阳五中、襄阳四中等)高三下学期第二次联考理综化学试卷(解析版) 题型:选择题
已知:pKa=-lgKa,25℃时,H2SO3的 pKa1=1.85,pKa2=7.19.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )

A.a点所得溶液中:2c(H2SO3)+c(SO32-)<0.1 mol•L-1
B.b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-)
C.c点所得溶液中:c(Na+)<3c(HSO3? )
D.d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省达州市年高二上学期期末检测化学试卷(解析版) 题型:实验题
(Ⅰ)某化学兴趣小组要完成中和热的测定.回答下列问题:
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol•L﹣1盐酸、0.55mol•L﹣1NaOH溶液,实验尚缺少的玻璃用品是_______.
(2)已知:反应后溶液的比热容c为4.18J·℃﹣1•g﹣1,0.5mol•L﹣1盐酸和0.55mol·L﹣1NaOH溶液的密度均为1g·cm﹣3.实验时记录的实验数据如下:
实验 次数 | 反应物及用量 | 溶 液 温 度 | ||
t1 | t2 | |||
1 | 50mL0.55mol•L-1NaOH溶液 | 50mL.0.5mol•L-1HCl溶液 | 20℃ | 23.3℃ |
2 | 50mL0.55mol•L-1NaOH溶液 | 50mL.0.5mol•L-1HCl溶液 | 20℃ | 23.5℃ |
①盐酸和氢氧化钠反应的中和热△H1=____________(保留两位小数)
②已知:CH3COOH(aq) CH3COO-(aq)+H+(aq) △H2>0 ,
CH3COO-(aq)+H+(aq) △H2>0 ,
CH3COOH(aq)+OH-(aq)= CH3COO-(aq)+H20(l) △H3 则△H3_____△H1(填“>”、“<”、“=”)
(Ⅱ)某实验小组利用硫酸酸化的KMnO4与H2C2O4反应来探究“外界条件对化学反应速率的影响”。该小组实验方案如下(实验测定KMnO4溶液完全褪色时间)。回答下列问题:
实验 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | H2O/mL | 温度/℃ | KMnO4溶液完全褪色时间(s) | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||||
① | 0.20 | 2.0 | 0.010 | 4.0 | 2.0 | 25 | t1 |
② | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 25 | t2 |
③ | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 50 | t3 |
(3)上述反应的离子方程式为______________________________________
(4)t1_____ t2(填“>”、“<”、“=”),其理由是__________________
(5)实验②和实验③两组实验的目的是______________________________
(6)有同学做实验时发现,硫酸酸化的KMnO4与H2C2O4反应开始时,溶液褪色慢,但反应一段时间后溶液褪色明显加快。针对上述实验现象,该同学提出下列猜想:
猜想①:硫酸酸化的KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。
猜想②:__________________(请你补充)
要证实猜想②,除硫酸酸化的高锰酸钾溶液、草酸溶液外,还需要选择的试剂是______。
A.硫酸钾 B.硫酸锰 C.水 D.氯化锰
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省达州市年高二上学期期末检测化学试卷(解析版) 题型:选择题
下列事实不能用勒夏特列原理解释的是
A. 溴水存在:Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B. 为提高合成氨反应的产率,可采取降低温度的措施
C. 反应CO(g)+NO2(g) CO2(g)+NO(g)△H<0,达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)△H<0,达平衡后,升高温度体系颜色变深
D. 可逆反应:2HI(g) H2(g)+I2(g)。达平衡后,缩小容器体积体系颜色变深
H2(g)+I2(g)。达平衡后,缩小容器体积体系颜色变深
查看答案和解析>>
科目:高中化学 来源:2017届浙江省教育绿色评价联盟高三3月适应性考试(选考)化学试卷(解析版) 题型:简答题
液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池。
已知:2NH3(g)  N2 (g)+3H2(g) △H= 92.4 kJ·mol-1
N2 (g)+3H2(g) △H= 92.4 kJ·mol-1
2H2 (g)+O2 (g)=2H2O(g) △H= - 483.6 kJ·mol-1
NH3(l)  NH3 (g) △H= 23.4 kJ·mol-1
NH3 (g) △H= 23.4 kJ·mol-1
(1) 4NH3(l)+3O2 (g) 2N2(g)+6H2O(g) 的△H=______,该反应的平衡常数表达式为______。
2N2(g)+6H2O(g) 的△H=______,该反应的平衡常数表达式为______。
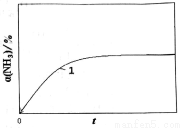
(2) 2NH3(g)  N2(g)十3H2(g)能自发的条件是_________(填“高温”或“低温”);恒温(T1)恒容时,催化分解初始浓度为c0的氨气,得氨气的转化率α(NH3)随时间t变化的关系如图曲线1。如果保持其他条件不变,将反应温度提高到T2,请在图中再添加一条催化分解初始浓度也为c0的氨气过程中α(NH3)~t的总趋势曲线_________(标注2)。
N2(g)十3H2(g)能自发的条件是_________(填“高温”或“低温”);恒温(T1)恒容时,催化分解初始浓度为c0的氨气,得氨气的转化率α(NH3)随时间t变化的关系如图曲线1。如果保持其他条件不变,将反应温度提高到T2,请在图中再添加一条催化分解初始浓度也为c0的氨气过程中α(NH3)~t的总趋势曲线_________(标注2)。
(3)有研究表明,在温度大于70℃、催化剂及碱性溶液中,可通过电解法还原氮气得到氨气,写出阴极的电极反应式______________________。
(4) 25℃时,将amol/L的氨水与b mol/L盐酸等体积混合(体积变化忽略不计),反应后溶液恰好显中性,用a、b表示NH3·H2O的电离平衡常数为_______________。
查看答案和解析>>
科目:高中化学 来源:福建省2016-2017学年高一3月月考化学试卷 题型:选择题
将过量的CO2分别通入①CaCl2溶液,②Na2SiO3溶液,③Ca(ClO)2溶液,④饱和Na2CO3溶液,最终有沉淀析出的是( )
A.①②③④ B.②④ C.①②③ D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com