
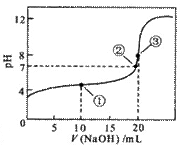 常温下,用0.1mol/L NaOH溶液滴定 20.00mL 0.1 mol/L CH3COOH溶液滴定曲线如右图。下列说法正确的是
常温下,用0.1mol/L NaOH溶液滴定 20.00mL 0.1 mol/L CH3COOH溶液滴定曲线如右图。下列说法正确的是
A. 点①所示溶液中:
c(CH3COO-)+ c(OH-) =c(CH3COOH)+ c(H+)
B. 点②所示溶液中:
c(Na+) =c(CH3COOH)+ c(CH3COO-)
C. 点③所示溶液中:
c(Na+)> c(OH-)> c(CH3COO-)> c(H+)
D. 滴定过程中可能出现:
c(CH3COOH)> c(CH3COO-)> c(H+)> c(Na+)> c(OH-)
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
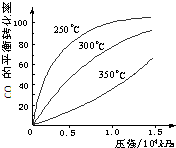 Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.| Q2-Q1 |
| 2 |
| Q2-Q1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
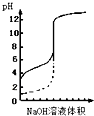
| A、△H>0的反应,常温下一定不能自发进行 | B、用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线 | C、常温下,在0.1mol/L氨水中,加入少量NH4Cl晶体,溶液的pH减小 | D、恒容密闭容器中进行的反应3A(g)?B(g)+C(g),在其它条件不变情况下,再充入一定量的A气体,A的转化率将增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com