
【题目】有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() 六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
A.被氧化和被还原的离子数目比为![]()
B.该反应说明![]() 、
、![]() 、、
、、![]() 在溶液不能大量共存
在溶液不能大量共存
C.每![]() 发生氧化反应,转移
发生氧化反应,转移![]()
D.若利用该反应设计原电池,则负极反应为:![]()
【答案】C
【解析】
由题意可以确定,铁元素的化合价升高,N元素的化合价格下降低,则有8Fe2++NO3-+10H+=8Fe3++NH4++3H2O,该反应中氧化剂(NO3-)与还原剂(Fe2+)物质的量之比为1:8; 若有lmol NO3- 发生还原反应,转移电子数为8mol;若把该反应设计成原电池,负极反应为Fe2+-e-=Fe3+,据此分析。
A.反应中氧化剂![]() 与还原剂
与还原剂![]() 物质的量之比为1:8,故A正确;
物质的量之比为1:8,故A正确;
B.酸性条件下![]() 可氧化
可氧化![]() ,说明
,说明![]() 、
、![]() 、
、![]() 在溶液不能大量共存,故B正确;
在溶液不能大量共存,故B正确;
C.若有![]() 发生还原反应,转移电子数为8mol,而不是氧化,故C错误;
发生还原反应,转移电子数为8mol,而不是氧化,故C错误;
D.若把该反应设计成原电池,负极发生氧化反应,电极反应为![]() ,故D正确。
,故D正确。
故选C。


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】淀粉通过如图所示转化可以得到多种有机物:
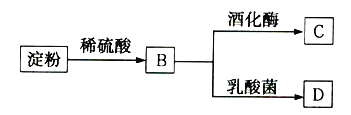
(1)检验淀粉是否完全水解,可以选用的试剂是__________(填序号)。
a.石蕊试液 b.淀粉碘化钾溶液 c.碘水
(2)B是一种单糖,则B的名称是____________________。
(3)B转化为C的化学方程式是______________________________。
(4)一分子B可在乳酸菌作用下分解生成两分子D,D与乙酸、乙醇均能发生酯化反应,且D的结构中含有甲基,则D的结构简式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等.已知碳酸锰难溶于水.一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如图1:阴离子膜法电解装置如图2所示:
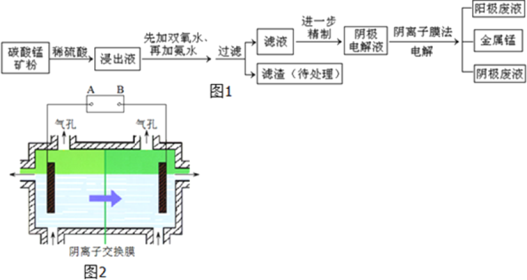
(1)写出用稀硫酸溶解碳酸锰反应的离子方程式______.
(2)已知不同金属离子生成氢氧化物沉淀所需的pH如表:
离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.3 |
沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 | 10.8 |
加氨水调节溶液的pH等于6,则滤渣的成分是______,滤液中含有的阳离子有H+和______.
(3)在浸出液里锰元素只以Mn2+的形式存在,且滤渣中也无MnO2,请解释原因______.
(4)电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的______极.实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为______.
(5)该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—铜空气燃料电池(如图)容量高、成本低,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法错误的是( )

A. 放电时,当电路中通过0.1 mol电子的电量时,有0.1molLi+透过固体电解质向Cu极移动,有标准状况下1.12L氧气参与反应
B. 整个反应过程中,氧化剂为O2
C. 放电时,正极的电极反应式为:Cu2O+H2O+2e-=2Cu+2OH-
D. 通空气时,铜被腐蚀,表面产生Cu2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:

已知:“反应Ⅱ”的离子方程式为Cu2++CuS+4C1-==2[CuCl2]-+S
回答下列问题:
(1)铁红的化学式为__________________;
(2)“反应Ⅱ”的还原剂是_______________(填化学式);
(3)“反应III”的离子方程式为____________________________________;
(4)辉铜矿的主要成分是Cu2S,可由黄铜矿(主要成分CuFeS2)通过电化学反应转变而成,有关转化如下如图 所示。转化时正极的电极反应式为___________________。
(5)从辉铜矿中浸取铜元素,可用FeCl3作浸取剂。
①反应Cu2S+4FeCl32CuCl2+4FeCl2+S,每生成1mol CuCl2,反应中转移电子的数目为______;浸取时,在有氧环境下可维持Fe3+较高浓度。有关反应的离子方程式是__________。
②浸取过程中加入洗涤剂溶解硫时,铜元素的浸取率的变化如图,其原因是_______________。


(6)CuCl悬浊液中加入Na2S,发生的反应为2CuCl(s)+S2-(aq)![]() Cu2S(s)+2Cl-(aq),该反应的平衡常数K =__________________[已知Ksp(CuCl)=1.2×10-6, Ksp(Cu2S)=2.5×10-43]。
Cu2S(s)+2Cl-(aq),该反应的平衡常数K =__________________[已知Ksp(CuCl)=1.2×10-6, Ksp(Cu2S)=2.5×10-43]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.12g NaHSO4晶体中阳离子和阴离子的总数为0.3NA
B.密闭容器中2 mol NO与1mol O2充分反应,产物的分子数目为2NA
C.在一定条件下,6.4g铜与过量的硫反应,转移的电子数目为0.2NA
D.10g质量分数为46%的乙醇溶液中O-H键数目为0.7NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2H4是一种高效清洁的火箭燃料。已知在25℃、101kPa下,8gN2H4(g)完全燃烧生成氮气和液态水时,放出133.5 kJ热量。则下列热化学方程中正确的是( )
A. N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ·mol-1
B. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-133.5kJ·mol-1
C. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=+534kJ·mol-1
D. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生产或实验事实引出的相应结论不正确的是( )
选项 | 事实 | 结论 |
A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间变短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
B | 工业制硫酸中,在SO3的吸收阶段,吸收塔里要装填瓷环 | 增大气液接触面积,使SO3的吸收速率增大 |
C | 在容积可变的密闭容器中发生反应:2NH3(g) | 正反应速率加快,逆反应速率减慢 |
D | A、B两支试管中分别加入等体积5%的H2O2,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 | 当其他条件不变时,催化剂可以改变化学反应速率 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
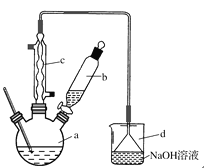
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。由b向a中加入4 mL液溴。烧瓶a中发生反应的化学方程式是______。装置d的作用是_________________;装置c的作用是__________________。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是________________________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是____________。
(3)经过上述分离操作后,粗溴苯中还含有的主要杂质的名称是________,进一步提纯操作方法是________。
(4)在该实验中,a的容积最适合的是________(填字母)。
A.25 mL B.50 mL C.250 mL D.500 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com