
【题目】氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) △H=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
(1)若某反应的平衡常数表达式为K=![]() ,请写出此反应的热化学方程式:_______;下列措施能够增大此反应中NO的转化率的是(填字母代号)_________。
,请写出此反应的热化学方程式:_______;下列措施能够增大此反应中NO的转化率的是(填字母代号)_________。
a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
①0~5min内,以CO2表示的该反应速率v(CO2)=______,该条件下的平衡常数K=________。
②第15 min后,温度调整到T2,数据变化如上表所示,则T1_______ T2(填“>”“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应_______移动(填“正向”“逆向”或“不”);最终达平衡时NO的转化率a=______________。
(3)在25 ℃下,向浓度均0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成_____沉淀(填化学式),当两种沉淀共存时,溶液中c(Mg2+)/c(Cu2+)=__________(已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)。
【答案】)2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=﹣747kJ/mol ad0.042mol·L-1·min-1
N2(g)+2CO2(g) △H=﹣747kJ/mol ad0.042mol·L-1·min-1![]() >正向60%Cu(OH)28.2×108或
>正向60%Cu(OH)28.2×108或![]() ×109
×109
【解析】
(1)根据平衡常数的定义,若平衡常数表达式为K= K=![]() ,则化学方程式为:2CO(g)+2NO(g)
,则化学方程式为:2CO(g)+2NO(g)![]() N2(g)+2CO2(g),已知①2C(s)+O2(g)=2CO(g) ΔH=﹣221 kJ/mol,②C(s)+O2(g)=CO2(g) △H=﹣393.5 kJ/mol,③N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
N2(g)+2CO2(g),已知①2C(s)+O2(g)=2CO(g) ΔH=﹣221 kJ/mol,②C(s)+O2(g)=CO2(g) △H=﹣393.5 kJ/mol,③N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
根据盖斯定律:②×2-①-③得:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=﹣747 kJ/mol; 由于该反应是气体体积减小的放热反应a.增大容器压强平衡正向移动,NO转化率增大,a正确;b.升高温度平衡逆向移动,NO转化率减小,b错误;c.使用优质催化剂不改变平衡,c错误;d.增大CO的浓度,可以提高NO的转化率,d正确;因此本题答案为:ad。(2)根据盖斯定律:上述已知反应②-③得:C(S)+2NO(g)
N2(g)+2CO2(g) △H=﹣747 kJ/mol; 由于该反应是气体体积减小的放热反应a.增大容器压强平衡正向移动,NO转化率增大,a正确;b.升高温度平衡逆向移动,NO转化率减小,b错误;c.使用优质催化剂不改变平衡,c错误;d.增大CO的浓度,可以提高NO的转化率,d正确;因此本题答案为:ad。(2)根据盖斯定律:上述已知反应②-③得:C(S)+2NO(g)![]() N2(g)+CO2(g) △H=﹣574.5 kJ/mol;①利用表格数据:0~5min内,以N2表示的该反应速v(N2)=
N2(g)+CO2(g) △H=﹣574.5 kJ/mol;①利用表格数据:0~5min内,以N2表示的该反应速v(N2)=![]() =0.042mol·L-1·min-1,所以以CO2表示的该反应速率v(CO2)= v(N2) =0.042mol·L-1·min-1;通过分析知10min后浓度不再改变,处于平衡状态,用三行式分析浓度改变
=0.042mol·L-1·min-1,所以以CO2表示的该反应速率v(CO2)= v(N2) =0.042mol·L-1·min-1;通过分析知10min后浓度不再改变,处于平衡状态,用三行式分析浓度改变
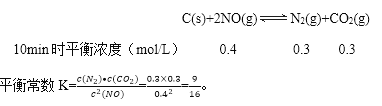
②第15 min后,温度调整到T2,从表格查得NO减少,N2增加,平衡正向移动,由于正反应为放热反应,改变条件为降温,则T1 >T2。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,此时各量分析如下:
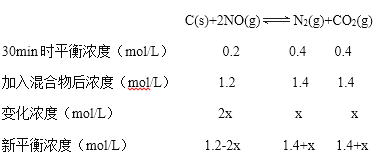
T2时平衡常数K=![]() =4, 加入混合物后Qc=
=4, 加入混合物后Qc=![]() =1.36<K,则此时反应正向移动;由于温度不变,平衡常数为定值,新平衡时有:
=1.36<K,则此时反应正向移动;由于温度不变,平衡常数为定值,新平衡时有:![]() =4,解得x=0.2;经计算NO起始总量为2mol+2mol=4mol,达到新平衡时NO的物质的量为(1.2-2×0.2)mol/L×2L=1.6mol,转化的NO共4mol-1.6mol=2.4mol,所以最终达平衡时NO的转化率a=
=4,解得x=0.2;经计算NO起始总量为2mol+2mol=4mol,达到新平衡时NO的物质的量为(1.2-2×0.2)mol/L×2L=1.6mol,转化的NO共4mol-1.6mol=2.4mol,所以最终达平衡时NO的转化率a=![]() 。(3)由于Ksp[Cu(OH)2]<Ksp[Mg(OH)2],所以先生成Cu(OH)2沉淀;当两种沉淀共存时,溶液是Cu(OH)2、Mg(OH)2的饱和溶液,溶液中OH-离子浓度相同,根据溶度积常数计算,溶液中c(Mg2+)/c(Cu2+)=
。(3)由于Ksp[Cu(OH)2]<Ksp[Mg(OH)2],所以先生成Cu(OH)2沉淀;当两种沉淀共存时,溶液是Cu(OH)2、Mg(OH)2的饱和溶液,溶液中OH-离子浓度相同,根据溶度积常数计算,溶液中c(Mg2+)/c(Cu2+)=![]() =
=![]() =8.2×108,故答案为:8.2×108 或
=8.2×108,故答案为:8.2×108 或![]() ×109。
×109。


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 将100mL0.1molL-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
B. 常温常压下,4.6 g C2H6O所含碳氢共价键数为0.6 NA
C. 2gD216O中含有的质子数、中子数,电子数均为NA
D. 向FeI2溶液中通入适量Cl2,当有lmolFe2+被氧化时,共转移的电子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量的铝铁合金与100mL很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4 mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
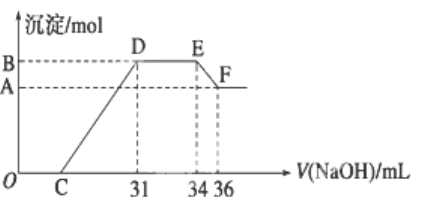
(1)结合OH-的能力最弱的是________(填离子符号)
(2)B与A的差值为________mol.
(3)原混合物中铝粉与铁粉的物质的量之比为______.
(4)B点对应的沉淀量为________mol,C点对应的溶液体积为________mL.
(5)硝酸溶液的物质的量浓度为_________mol·L-1
(6)写出铝与该浓度硝酸反应的离子方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸铜的方法很多:
(1)方法一:用浓硫酸和铜制取硫酸铜。该反应的化学方程式是_______________________。
(2)方法二:实验证明,铜不能在低温下与O2反应,也不能与稀H2SO4共热发生反应,但工业上却是将废铜屑倒入热的稀H2SO4中并通入空气来制备CuSO4溶液的。铜屑在此状态下被溶解的化学方程式为_____________________________。
(3)以上两种方法________(填“前”或“后”)者好,原因是________________________。
(4)方法三:用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:
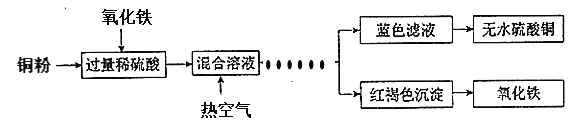
稀硫酸和氧化铁反应的离子方程式是_____________________________(反应①);铜和上述反应(反应①)得到的物质反应的离子方程式是_________________________;向混合溶液中通入热空气的目的是_______________________________;分离蓝色滤液和红褐色沉淀的实验操作是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质均为a g,将它们在氧气中完全氧化的产物全部通入到足量的过氧化钠固体中,过氧化钠固体增重为a g,符合条件的物质种类有( )
①CO ②H2 ③CH4 ④HCHO ⑤CH3COOH ⑥HCOOH
A. 4 种 B. 5 种 C. 6种 D. 2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是信息技术的关键材料,在工业中可利用镁制取硅:2Mg(过量)+SiO2![]() 2MgO+Si,2Mg+Si
2MgO+Si,2Mg+Si![]() Mg2Si(副反应),查资料得:①Mg2Si遇盐酸迅速反应生成SiH4(硅烷);②SiH4在常温下是一种不稳定易分解、易自燃的气体;③Mg在加热时能与CO2、N2反应。
Mg2Si(副反应),查资料得:①Mg2Si遇盐酸迅速反应生成SiH4(硅烷);②SiH4在常温下是一种不稳定易分解、易自燃的气体;③Mg在加热时能与CO2、N2反应。
I.如图是实验室进行Mg与SiO2反应的裝置:
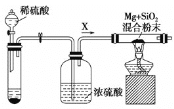
(1)盛放稀硫酸的装置为_________________,由于氧气的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用_________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸。可观察到闪亮的火星,产生此现象的原因用化学方程式表示为 ①____________________; ②_________________。
II.利用如图装置(量气管“0”刻度在刻度线的最上方)可测定生成物的纯度。
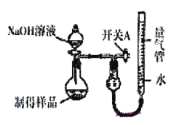
(3)实验开始前应先_________________。
(4)若取样品Wg加入5mLNaOH(足量)充分反应。反应前量气管液面读数为V1mL,反应后为V2mL(实验数据均转化为标准状况下),则样品的纯度为____________________。(写出计算式,不化简)。
(5)若反应结束时读数前未调节量气装置两边液面高度相平(右边的液面高于左边液面),则会导致实验结果______(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 和
和![]() 在溶液中有:2
在溶液中有:2![]() (黄)+2H+
(黄)+2H+![]()
![]() (橙)+H2O的转化。室温下初始浓度为1.0 mol/L的Na2CrO4溶液中c(
(橙)+H2O的转化。室温下初始浓度为1.0 mol/L的Na2CrO4溶液中c(![]() )随c(H+)的变化如图所示。不正确的是( )
)随c(H+)的变化如图所示。不正确的是( )

A. 向Na2Cr2O7溶液中加NaOH固体,溶液的颜色为黄色
B. 由图可知,溶液酸性增大,![]() 的平衡转化率增大
的平衡转化率增大
C. 根据A点数据计算出该转化反应的平衡常数为1 (mol·L-1)-3
D. 温度升高,溶液中![]() 的平衡转化率减小,则该反应为放热反应
的平衡转化率减小,则该反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有HCl和AlCl3的混合溶液中加入NaOH溶液,生成的沉淀和加入NaOH溶液的体积关系的大致图像为
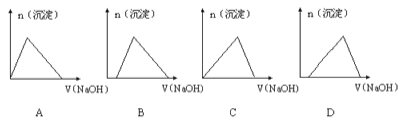
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是一种重要的氧化物,可用于生产三氧化硫、硫酸、亚硫酸盐、硫代硫酸盐,也可用作熏蒸剂、防腐剂、消毒剂、还原剂等。
(1)SO2性质多变,若将SO2气体通入氢硫酸中,能看到的现象为:__________,该反应中SO2表现出______性;若将SO2气体通入酸性高锰酸钾溶液中,离子反应方程式为_________,该反应中SO2表现出__________性。
(2)SO2有毒,且能形成酸雨,是大气主要污染物之一。石灰-石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收原理:①SO2+Ca(OH)2=CaSO3↓+H2O②2CaSO3+O2+4H2O=2CaSO4·2H2O碱法的吸收原理:将含SO2的尾气通入足量的烧碱溶液中,请写出对应的化学反应方程式__________;
已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
余石灰-石膏法相比,碱法的优点是吸收快、效率高,缺点是__________;
(3)在石灰-石膏法和碱法的基础上,设计了双碱法,能实现物料循环利用。

上述方法中,实现循环利用的物质是__________,请用化学方程式表示在Na2SO3溶液中加入CaO后的反应原理__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com