
 )常用于汽水、糖果的添加剂,
)常用于汽水、糖果的添加剂,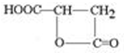 .
. 分析 有机物中含有2个-COOH和1个-OH,可与钠反应生成氢气,与碳酸钠反应生成二氧化碳气体,可发生酯化反应,以此解答该题.
解答 解:(1)与结构简式可知有机物含有的官能团为羟基、羧基,故答案为:羟基、羧基;
(2)①有机物中含有2个-COOH和1个-OH,都可与钠反应生成氢气,反应的方程式为2HOOCCH(OH)CH2COOH+6Na→2NaOOCCH(ONa)CH2COONa+3H2↑,
故答案为:2HOOC-CH(OH)-CH2-COOH+6Na→2NaOOC-CH(ONa)-CH2-COONa+3H2↑;
②分子中含有2个羧基,具有酸性,可与碳酸钠反应,反应的方程式为Na2CO3+HOOC-CHOH-CH2COOH→NaOOC-CHOH-CH2COONa+CO2↑+H2O,
故答案为:HOOC-CH(OH)-CH2-COOH+Na2CO3→NaOOC-CH(OH)-CH2-COONa+CO2↑+H2O;
(3)分子中含有羧基和羟基,可发生酯化反应生成四元环酯,结构简式为 ,故答案为:
,故答案为: .
.
点评 本题考查有机物的结构和性质,为高考常见题型和高频考查,侧重于学生的分析能力的考查,注意把握有机物的官能团的性质,为解答该题的关键,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
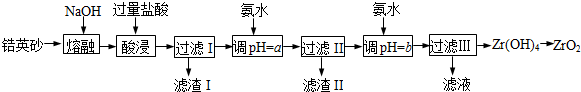
| 金属离子 | Fe3+ | Al3+ | ZrO2+ |
| 开始沉淀时pH | 1.9 | 3.3 | 6.2 |
| 沉淀完全时pH | 3.2 | 5.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将水加热煮沸 | B. | 向水中投入一小块金属钠 | ||
| C. | 向水中通入二氧化硫气体 | D. | 向水中加食盐晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IA族与ⅦA族元素间可形成共价化合物或离子化合物 | |
| B. | 第二周期元素从左到右,最高正价从+1递增到+7 | |
| C. | 随核电荷数递增,同主族元素的简单阴离子还原性递增减 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| X | Y | ||
| Z | W | M |
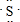 ;它的气态氢化物的结构式为H-S-H.
;它的气态氢化物的结构式为H-S-H.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应①是加成反应 | B. | 反应②是加聚反应 | ||
| C. | 反应③是还原反应 | D. | 反应④⑤⑥⑦是取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 大理石放入稀硝酸中:CO32-+2H+═CO2↑+H2O | |
| C. | 铝片插入浓烧碱溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 稀硫酸与氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com