
��ҵ����ˮú���ķ�ӦΪ��C��s���� H2O��g��=CO��g����H2��g������H����131.4 kJ��mol��1�������ж���ȷ���ǣ���������
| A����Ӧ�������ܺʹ��������������ܺ� |
| B��CO��g����H2��g��=C��s����H2O��l�� ��H����131.4 kJ��mol��1 |
| C��ˮú����Ӧ������1 mol H2��g������131.4 kJ���� |
| D��ˮú����Ӧ������1���CO��g������131.4 kJ���� |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪��2Zn(s)+O2(g)=2ZnO(s) ��H="-701.0" kJ?mol-1
2Hg(I)+O2(g)=2HgO(s) ��H="-181.6" kJ?mol-1
��ӦZn(s)+HgO(s)=ZnO(s)+Hg(I)�ġ�HΪ
| A��-519.4kJ?mol-1 | B��+259.7 kJ?mol-1 | C��-259.7 kJ?mol-1 | D��+519.4 kJ?mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��ѧ��Ӧ�е������仯���ɻ�ѧ��Ӧ�оɻ�ѧ������ʱ���յ��������»�ѧ���γ�ʱ�ų���������ͬ����ġ���ͼΪN2(g)��O2(g)��Ӧ����NO(g)�����е������仯������˵����ȷ���ǣ� ��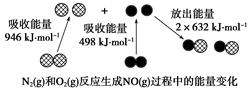
| A��1 mol N2(g)��NA��O2(g)��Ӧ�ų�������Ϊ180 kJ |
| B��1 mol N2(g)��1 mol O2(g)������������2 mol NO(g)��������� |
| C��ͨ������£�N2(g)��O2(g)�����ֱ������NO |
| D��NO��һ���������������NaOH��Һ��Ӧ�����κ�ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
ij��Ӧ�Ħ�H��+100 kJ��mol��1�������йظ÷�Ӧ��������ȷ����( )
| A������Ӧ���С��100 kJ��mol��1 |
| B���淴Ӧ���һ��С��100 kJ��mol��1 |
| C������Ӧ��ܲ�С��100 kJ��mol��1 |
| D������Ӧ��ܱ��淴Ӧ��ܴ�100 kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ���������ַ�Ӧԭ����
��CH3OH��g����H2O��g��=CO2��g����3H2��g��
��H1����49.0 kJ/mol��
��CH3OH��g����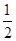 O2��g��=CO2��g����2H2��g��
O2��g��=CO2��g����2H2��g��
��H2����192.9 kJ/mol��
����������Ӧ������˵����ȷ���ǣ�������
| A����Ӧ���е������仯����ͼ��ʾ |
| B��CH3OHת���H2�Ĺ���һ��Ҫ�������� |
| C��1 mol CH3OH���ȼ�շų�������Ϊ192.9 kJ |
| D������֪2H2��g����O2��g��=2H2O��g�� ��H����483.8 kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��25 �桢101 kPaʱ��CH4(g)��H2(g)��C(s)��ȼ���ȷֱ��ǣ�890.3 kJ��mol��1����285.8 kJ��mol��1�ͣ�393.5 kJ��mol��1����CH4(g)�D��C(s)��2H2(g)�Ħ�H��(����)
| A����74.8 kJ��mol��1 | B����74.8 kJ��mol��1 |
| C����211.0 kJ��mol��1 | D����211.0 kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪Zn��s����H2SO4��aq��=ZnSO4��aq����H2��g������H<0����������������ȷ���ǣ�������
| A���÷�Ӧ�Ħ�Hֵ�뷴Ӧ�������� |
| B���÷�Ӧ�Ļ�ѧ�ܿ���ת��Ϊ���� |
| C����Ӧ�������������������������� |
| D���÷�Ӧ�з�Ӧ��Ļ�ѧ�����ѷų������������ﻯѧ���γ��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
25 �桢101 kPa�£�̼������������������ǵ�ȼ���������Ǧ�H����393.5 kJ/mol����H����285.8 kJ/mol����H����890.3 kJ/mol����H����2 800 kJ/mol���������Ȼ�ѧ����ʽ��ȷ����(����)
A��C(s)��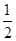 O2(g)=CO(g)��H����393.5 kJ/mol O2(g)=CO(g)��H����393.5 kJ/mol |
| B��2H2(g)��O2(g)=2H2O(l)��H����571.6 kJ/mol |
| C��CH4(g)��2O2(g)=CO2(g)��2H2O(g)��H����890.3 kJ/mol |
D��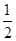 C6H12O6(s)��3O2(g)=3CO2(g)��3H2O(g)��H����1 400 kJ/mol C6H12O6(s)��3O2(g)=3CO2(g)��3H2O(g)��H����1 400 kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪��Ȳ�뱽������ȫȼ�յ��Ȼ�ѧ����ʽ���£�
��C2H2(g)��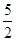 O2(g)�D��2CO2(g)��H2O(l) ��H����1 300 kJ��mol��1
O2(g)�D��2CO2(g)��H2O(l) ��H����1 300 kJ��mol��1
��C6H6(g)��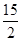 O2(g)�D��6CO2(g)��3H2O(l) ��H����3 295 kJ��mol��1
O2(g)�D��6CO2(g)��3H2O(l) ��H����3 295 kJ��mol��1
����˵����ȷ���� (����)��
| A��1 mol C2H2(g)��ȫȼ��������̬ˮʱ���ȴ���1 300 kJ |
| B��1 mol C6H6(l)��ȫȼ������Һ̬ˮʱ���ȴ���3 295 kJ |
| C����ͬ�����£���������C2H2(g)��C6H6(g)��ȫȼ�գ�C6H6(g)���ȸ��� |
| D��C2H2(g)��������C6H6(g)�Ĺ������ڷ��ȷ�Ӧ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com