
 2NH3��������ͼ�жϣ�
2NH3��������ͼ�жϣ�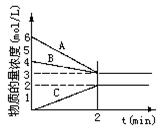
 2C�ﵽ�˻�ѧƽ��״̬�������ƽ��ʱC��A2��= 0.5mol��L��C��B2��="0.1mol/L" C��C��=" 1.6" mol/L����A2��B2��C����ʼŨ�ȷֱ���a mol/L��b mol/L��cmol/L��ʾ����ش�
2C�ﵽ�˻�ѧƽ��״̬�������ƽ��ʱC��A2��= 0.5mol��L��C��B2��="0.1mol/L" C��C��=" 1.6" mol/L����A2��B2��C����ʼŨ�ȷֱ���a mol/L��b mol/L��cmol/L��ʾ����ش�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����¡���ѹʱ���백�� | B�����¡�����ʱ���뵪�� |
| C�����¡�����ʱ���뺤�� | D�����¡���ѹʱ���뺤�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2Z(g)���¶ȷֱ�ΪT1��T2ʱ��X��ת���ʦ�(X) ��ʱ��仯�Ĺ�ϵ��ͼ�����н�����ȷ����
2Z(g)���¶ȷֱ�ΪT1��T2ʱ��X��ת���ʦ�(X) ��ʱ��仯�Ĺ�ϵ��ͼ�����н�����ȷ����
| A���÷�Ӧ����Ӧ���� |
| B���ﵽƽ��������������䣬ͨ��ϡ�����壬ƽ��������Ӧ�����ƶ� |
| C���ﵽƽ��������������䣬�����¶ȣ����淴Ӧ���ʾ���С��Z���������Ҳ��С |
| D����T2��ʱ������ʼ����1mol X��3mol Y��2mol Z���ﵽƽ����(X)��0.25 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 5 kJ/mol
5 kJ/mol | A���Ӵ���ͬʱ�����¶� | B���Ӵ���ͬʱ����ѹǿ |
| C�������¶�ͬʱ����N2 | D�������¶�ͬʱ����ѹǿ |
 ��������ţ�
��������ţ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������

 2C��g������H<0��
2C��g������H<0���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
| ʱ��/s Ũ��mol��L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
| c��N2O4��mol��L-1 | 0.100 | c1 | 0.050 | c3 | a | b |
| c��NO2��/mol��L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 xC(g)�ﵽƽ�⣬��ʱ��üס�����������C�����������Ϊ0.2��
xC(g)�ﵽƽ�⣬��ʱ��üס�����������C�����������Ϊ0.2���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2NH3��g��;��H=" " -92.2KJ��mol-1,��֪��ƽ��ʱ�����������ѹǿΪ��ʼ��80%.
2NH3��g��;��H=" " -92.2KJ��mol-1,��֪��ƽ��ʱ�����������ѹǿΪ��ʼ��80%. ��ƽ��״̬ʱ���ų�������Ϊ
��ƽ��״̬ʱ���ų�������Ϊ  __
__�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com