
分析 (1)溶于水,得到无色溶液和白色沉淀,白色沉淀可能为AgCl或碳酸银,一定不含KI,而一定含Na2CO3;
(2)过滤后,在沉淀中加入稀硝酸,沉淀部分溶解并产生气泡,则白色沉淀为AgCl和碳酸银,即一定含NaCl、Na2CO3、AgNO3,以此来解答.
解答 解:(1)溶于水,得到无色溶液和白色沉淀,白色沉淀可能为AgCl或碳酸银,一定不含KI,而一定含Na2CO3;
(2)过滤后,在沉淀中加入稀硝酸,沉淀部分溶解并产生气泡,气体为二氧化碳,则白色沉淀为AgCl和碳酸银,即一定含NaCl、Na2CO3、AgNO3,
综合所述,肯定存在NaCl、Na2CO3、AgNO3,肯定不存在KI,可能存在KNO3,
故答案为:NaCl、Na2CO3、AgNO3;KI;KNO3.
点评 本题考查物质的检验和鉴别,为高频考点,把握物质之间的反应及白色沉淀的成分为解答本题的关键,侧重分析与应用能力的考查,题目难度不大.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 摩尔既是物质的量的单位又是物质的质量单位 | |
| B. | 物质的量既表示物质的数量又表示物质的质量 | |
| C. | 阿伏加德罗常数是12kg碳12中含有的碳原子数目 | |
| D. | 1molH2O中含有10mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O的相对分子质量是18克 | |
| B. | H2O的摩尔质量是18克 | |
| C. | 标准状况下H2O的摩尔体积是22.4L.mol-1 | |
| D. | 1mol H2O的质量是18克 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,属于芳香烃的是c(填字母),它与苯的关系是同系物,写出苯与溴发生反应的化学方程式
,属于芳香烃的是c(填字母),它与苯的关系是同系物,写出苯与溴发生反应的化学方程式 ,预测该芳香烃能(填“能”或“不能”)发生该类反应.
,预测该芳香烃能(填“能”或“不能”)发生该类反应.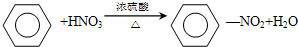 ,属于取代反应.③由苯制取环己烷:
,属于取代反应.③由苯制取环己烷: ,属于加成反应.
,属于加成反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入2molX、2molY,起始时,VA=aL,VB=0.8aL(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:
图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入2molX、2molY,起始时,VA=aL,VB=0.8aL(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com